题目内容
【题目】为测定Na2CO3与Na2SO3混合物中Na2CO3的含量,某同学设计了如图所示的装置进行实验(铁架台、铁夹等仪器未在图中画出).请回答下列问题: 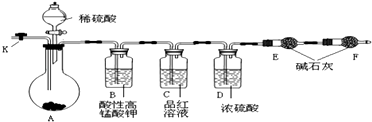
(1)将仪器连接好以后,必须进行的第一步操作是 .
(2)装置B的作用是;装置D的作用 .
(3)实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气.这样做的目的是 . 否则可能引起Na2CO3含量的测定值比实际值(填“偏高”、“偏低”或“没影响”).
(4)Na2CO3与Na2SO3混合物23.2g进行实验,实验结束后,发现E装置增重了4.4g,Na2CO3的含量为
(5)实验过程中硫酸要加入过量的原因
(6)已知MnO4﹣酸性条件下会与具有还原性的物质反应转化成Mn2+ , 试写出装置B中反应的离子方程式
【答案】
(1)检验装置的气密性
(2)吸收二氧化硫;吸收水蒸气
(3)使生成的二氧化碳气体能够被装置E中的药品完全吸收;偏低
(4)45.7%
(5)让样品与硫酸充分反应,不影响反应的测定结果
(6)2MnO4﹣+5SO2+2H2O═5SO42﹣+2Mn2++4H+
【解析】解:根据实验目的,结合实验装置原理可以判断:A为发生装置,反应后生成二氧化碳和二氧化硫气体及少量的水蒸气杂质,为了准确测定生成CO2气体的质量,首先要除尽SO2 , 因此B中应装入酸性高锰酸钾溶液,C装置用来检验SO2气体是否被完全吸收,可以选用品红溶液,在吸收二氧化碳之前,要再除去杂质水蒸气,因此D中应装入浓硫酸,为了吸收二氧化碳,E装置应装入碱石灰,为了防止空气中的水蒸气、二氧化碳等杂质进入E,应在F中加入碱石灰起保护作用,为了能使反应后装置中的二氧化碳完全被碱石灰吸收,反应结束后在装置中通入氮气,用氮气将二氧化碳压到碱石灰中,(1)将仪器连接好以后,必须进行的第一步操作是检验装置的气密性,所以答案是:检验装置的气密性;(2)根据上面的分析可知,装置B的作用是 吸收二氧化硫;装置D的作用 吸收水蒸气,
所以答案是:吸收二氧化硫;吸收水蒸气;(3)根据上面的分析可知,通入大量的氮气,这样做的目的是 使生成的二氧化碳气体能够被装置E中的药品完全吸收,否则由于二氧化碳没有完全被吸收,而使得计算出的Na2CO3含量的测定值比实际值 偏低,
所以答案是:使生成的二氧化碳气体能够被装置E中的药品完全吸收;偏低;(4)Na2CO3与Na2SO3混合物23.2g进行实验,实验结束后,发现E装置增重了4.4g,即反应中生成了二氧化碳的质量为4.4g,根据关系式Na2CO3~CO2可知,Na2CO3的质量为10.6g,所以Na2CO3含量为 ![]() ×100%=45.7%,
×100%=45.7%,
所以答案是:45.7%;(5)实验过程中硫酸要加入过量的原因是让样品与硫酸充分反应,不影响反应的测定结果,
所以答案是:让样品与硫酸充分反应,不影响反应的测定结果; (6)装置B中二氧化硫被高锰酸钾氧化成硫酸根离子,所以反应的离子方程式为2MnO4﹣+5SO2+2H2O═5SO42﹣+2Mn2++4H+ ,
所以答案是:2MnO4﹣+5SO2+2H2O═5SO42﹣+2Mn2++4H+ .




