题目内容
7. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的简单阴离子比W的简单阴离子还原性强 | |
| C. | Y与Z形成的化合物都可以和盐酸反应 | |
| D. | Z的最高价氧化物对应的水化物一定是强碱 |
分析 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.W的单质是黄色固体,W为S,Q的原子序数最大,Q为Cl,由X、Y、W在周期表中的相对位置可知,Y为O,X为C;其中只有Z是金属,Z的原子序数大于8且小于16,则Z为Na或Mg、Al,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Na或Mg、Al,W为S,Q为Cl,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径最大的是Z,故A错误;
B.非金属性O>S,则的简单阴离子比W的简单阴离子还原性弱,故B错误;
C.Y与Z形成的化合物为氧化钠(过氧化钠)或MgO或氧化铝,均与盐酸反应生成盐,故C正确;
D.Z的最高价氧化物对应的水化物为NaOH时为强碱,而氢氧化镁、氢氧化铝不是强碱,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素的位置、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | 将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+ )<c(Cl- ) | |
| B. | 向 NH4Cl 溶液中通 NH3,则 c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) | |
| C. | 室温下,c(NH4+ )相同的①(NH4)2 CO3②(NH4)2 SO4 ③(NH4)2 Fe(SO4)2溶液浓度大小顺序为:①>②>③ | |
| D. | 已知 pKa=-lgKa,pKa(HF)=3.1,pKa(C6H5COOH)=4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者 |
15.下列过程中吸收能量的是( )
| A. |  | B. |  | ||
| C. | 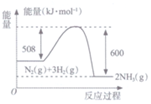 | D. |  |
2.下列鉴别物质的方法能达到目的是( )
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液 | |
| D. | 用淀粉溶液鉴别加碘盐和未加碘盐(己知加碘盐中添加的是KIO3) |
12.下列叙述正确的是( )
| A. | 吸热反应是指反应物的总能量高于生成物的总能量 | |
| B. | 放热反应是指反应物的总键能高于生成物的总键能 | |
| C. | 核外电子总数相同的电中性原子,一定是同种元素的原子 | |
| D. | 二氧化氮与水反应能生成硝酸,所以二氧化氮是酸性氧化物 |
20.某烷烃的各种同分异构体中,主链上有4个碳原子的 只有两种,则含有相同碳原子数且主链上也有4个碳原子的单烯烃有( )
| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |
1.用式量是71的烃基取代乙苯苯环上的一个氢原子,能得到的有机物共有(不含立体异构)( )
| A. | 8种 | B. | 16种 | C. | 24种 | D. | 36种 |

 ;
; .
. .
. .
.
 .
.