题目内容
有人建议将氢元素排在元素周期表的第ⅦA族。下列事实能支持这一观点的是( )
①氢原子得到一个电子后最外层电子达到稳定结构 ②氢分子的结构式为H—H
③与碱金属元素形成离子化合物M+[∶H]- ④分子中原子间的化学键都属于非极性键
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
A
解析试题分析:ⅦA族元素原子在反应中易获得一个电子,在化合物中元素的化合价为-1价,易形成离子化合物。①H原子得到一个电子实现最外电子层稳定结构,在化合物中元素的化合价为-1价,符合ⅦA族元素的化合价,正确;②氢分子的结构式为H-H,符合ⅦA族元素各提供1个电子形成一对共用电子对,正确;③与碱金属元素形成离子化合物M+[:H]-,符合ⅦA族元素与碱金属形成离子化合物的特点,正确;④不只ⅦA族元素分子中原子间的化学键都属于非极性键,不支持氢元素排在元素周期表的ⅦA族的观点,错误。
考点:考查氢元素的位置及ⅦA族元素的性质。

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
已知X、Y是主族元素,I为电离能。请根据下表所列数据判断,错误的是
| I/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有②⑤⑦ | B.②⑥⑦ | C.②④⑤⑥⑦ | D.②④⑥ |
下列叙述中错误的是 ( )
| A.原子半径:Cl>S>O | B.还原性:Na>Mg>Al |
| C.稳定性:HF>HCl>HBr | D.酸性:HClO4>H2SO4>H3PO4 |
关于下列各组物质的相互关系,判断正确的是( )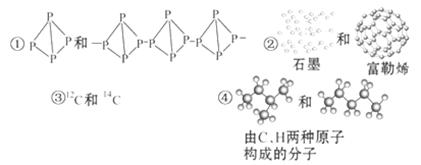

| A.互为同素异形体的是①② | B.互为同位素的是②③ |
| C.互为同一物质的是①⑤ | D.互为同分异构体的是④⑤ |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )[来源&:中*^教@#网]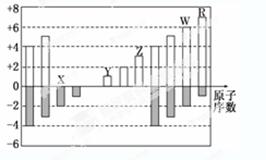
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:W>R |
| C.WX3和水反应形成的化合物是离子化合物[来*源#^@:中国教育出版~网] |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
下列说法正确的是
| A.元素周期表中一共有7个周期和18个族 |
| B.金属元素的原子最外层电子数一定都小于4 |
| C.质量数不同的两种原子,一定不互为同位索 |
| D.主族元素X的原子序数为a,所在周期的元素种数为b,则与x同族的下一周期的元素Y的原于序数一定为a+b |
下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
| A.2,4,6 | B.19,20,21 | C.1,3,5 | D.8,16,18 |