题目内容
14.在人们生产、生活等各种活动中都离不开化学物质,比如:金属是人类生活中用途广泛的金属材料,即使有毒的苯也是重要的化工原料,请回答下面与金属和苯有关的问题:Ⅰ.写出下列反应的化学方程式.
(1)用铝加热反应炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)由苯制取硝基苯:
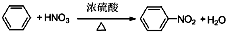 ;
;Ⅱ.现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生;②把Z、W用导线连接后同时浸入稀硫酸溶液中,溶液中H+移向W;③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z.
(1)在①中,金属片发生氧化反应Y;
(2)在②中,金属片Z作负极;
(3)如果把Y、W用导线连接后同时浸入稀硫酸溶液,则金属片W上有气泡产生;
(4)上述四种金属的活动顺序是Y>X>Z>W.
分析 I.(1)高温条件下,铝和氧化铁发生铝热反应生成氧化铝和铁;
(2)在浓硫酸作催化剂、加热条件下,苯和浓硝酸发生取代反应生成硝基苯;
II.在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上发生氧化反应、正极上发生还原反应;电子从负极沿导线流向正极,电解质溶液中阴离子向负极移动、阳离子向正极移动;
现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,说明X是正极、Y是负极,则金属活动性Y>X;
②把Z、W用导线连接后同时浸入稀硫酸溶液中,溶液中H+移向W,则W是正极、Z是负极,金属活动性Z>W;
③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z,则X是负极、Z是正极,金属活动性X>Z,
通过以上分析知,金属活动性顺序是Y>X>Z>W,结核题目分析解答.
解答 解:I.(1)高温条件下,铝和氧化铁发生铝热反应生成氧化铝和铁,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)在浓硫酸作催化剂、加热条件下,苯和浓硝酸发生取代反应生成硝基苯,反应方程式为 ,
,
故答案为: ;
;
II.在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上发生氧化反应、正极上发生还原反应;电子从负极沿导线流向正极,电解质溶液中阴离子向负极移动、阳离子向正极移动;
现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,说明X是正极、Y是负极,则金属活动性Y>X;
②把Z、W用导线连接后同时浸入稀硫酸溶液中,溶液中H+移向W,则W是正极、Z是负极,金属活动性Z>W;
③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z,则X是负极、Z是正极,金属活动性X>Z,
通过以上分析知,金属活动性顺序是Y>X>Z>W,
(1)在①中,Y是负极、X是正极,负极上Y失电子发生氧化反应,故答案为:Y;
(2)在②中,金属片Z作负极、W作正极,故答案为:Z;
(3)金属性Y>W,如果把Y、W用导线连接后同时浸入稀硫酸溶液,构成原电池,Y是负极、W是正极,则金属片W上有气泡产生,故答案为:W;
(4)通过以上分析知,上述四种金属的活动顺序是Y>X>Z>W,
故答案为:Y>X>Z>W.
点评 本题考查金属活动性强弱判断及化学方程式的书写,侧重考查原电池原理及铝和苯的性质,明确正负极判断方法是解本题关键,注意:金属活动性强弱与失电子难易程度有关,与失电子多少无关,题目难度不大.

| 选项 | A | B | C | D |
| 正极 | Cu | Mg | C | Zn |
| 负极 | Zn | Zn | Zn | Cu |
| 电解质溶液 | H2SO4 | CuSO4 | CuCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
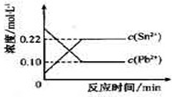 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 | |
| D. | 当溶液中固体质量不再变化时达到平衡状态 |
| A. | 锌置换法 | B. | 铝热反应法 | C. | 氢气置换法 | D. | 电解法 |
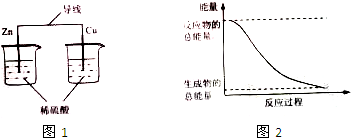
| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化石燃料是可再生能源,燃烧时将化学能转变为热能 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
| A. | 溶液是电中性的,胶体则是带电的 | |
| B. | 次氯酸具有强氧化性,属于强电解质 | |
| C. | 铜在氯气中燃烧产生棕色的烟,产物的稀溶液为蓝色 | |
| D. | 铁与稀硝酸充分反应后铁没有剩余,则溶液中一定有Fe3+ |
| A. | 若溶液是强酸溶液,该溶液中一定含有分子 | |
| B. | 若溶液显碱性,该溶液一定是碱溶液 | |
| C. | 无论是强酸溶液还是强碱溶液,加入金属Al一定会放出H2 | |
| D. | 向该溶液中加入酸化的BaCl2溶液,可验证是否含有SO42- |
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | 简单阴离子还原性X大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
| A. | 通入X溶液浑浊,通入Y无明显现象 | B. | 通入X现象不明显,通入Y溶液浑浊 | ||
| C. | 通入X和Y溶液均无明显现象 | D. | 通入X和Y溶液均浑浊 |