��Ŀ����
����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȵ����⣮��֪��CO ��g��+H2O ��g��H2 ��g��+CO2 ��g��ƽ�ⳣ��K���¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�ش���������
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H=0�������������������=����
��2������һ���¶��£�C��s��+CO2 ��g��2CO ��g��ƽ�ⳣ��K1��
C ��s��+H2O��g��CO��g��+H2 ��g��ƽ�ⳣ��K2��K��K1��K2 �� ֮��Ĺ�ϵ����
��3��800��ʱ����һ��10L�ĺ��ݷ�Ӧ���г���0.40molCO��1.60molˮ��������һ��ʱ���Ӧ�ﵽƽ�⣬��ʱCO��ת����Ϊ�������������������䣬��ƽ����ϵ����ͨ��0.10molCO��0.40molCO2 �� ��ʱv��v�� �����������=����������
���𰸡�
��1��![]() ����
����
��2��K= ![]()
��3��80%��=
���������⣺��1��ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮������K= ![]() ������ͼ�����ݷ����������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
������ͼ�����ݷ����������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
���Դ��ǣ�K= ![]() ��������2����C��s��+CO2��g��2CO��g��ƽ�ⳣ��K1����C��s��+H2O��g��CO��g��+H2��g��ƽ�ⳣ��K2����CO��g��+H2O��g��H2��g��+CO2��g��ƽ�ⳣ��K����=�ک��٣���K=
��������2����C��s��+CO2��g��2CO��g��ƽ�ⳣ��K1����C��s��+H2O��g��CO��g��+H2��g��ƽ�ⳣ��K2����CO��g��+H2O��g��H2��g��+CO2��g��ƽ�ⳣ��K����=�ک��٣���K= ![]() ��
��
���Դ��ǣ�K= ![]() ����3�����ڷ�Ӧ CO��g��+H2O��g��H2��g��+CO2��g����
����3�����ڷ�Ӧ CO��g��+H2O��g��H2��g��+CO2��g����
CO��g�� | + H2O��g�� | H2��g�� | + CO2��g�� | |
��ʼ��mol/L���� | 0.04 | 0.16 | 0 | 0 |
�仯��mol/L���� | c | c | c | c |
ƽ�⣨mol/L���� | 0.04��c | 0.16��c | c | c |
���� ![]() =9�����c=0.032
=9�����c=0.032
����CO��ת����Ϊ ![]() ��100%=80%��
��100%=80%��
��ƽ��ʱ����Ϊ��
���ڷ�Ӧ CO��g��+H2O��g��H2��g��+CO2��g����
��ʼ��mol/L����0.04 0.16 0 0
�仯��mol/L�� 0.032 0.032 0.032 0.032
ƽ�⣨mol/L����0.008 0.128 0.032 0.032
�ı�����Ϊ��CO��g��+H2O��g��H2��g��+CO2��g����
�ı��mol/L����0.018 0.128 0.032 0.072
Qc= ![]() =1=K������ƽ�ⲻ�ƶ���
=1=K������ƽ�ⲻ�ƶ���
���Դ��ǣ�80%��=��
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״����ڹ̶������н��У���2H2��g��+CO��g��CH3OH��g��
��1��������������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K��
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ٸ÷�Ӧ���ر��S0 �� �����������=�������÷�Ӧ��������»���£����������Է����У�
��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��������ţ���
a������ b��������� c������CO��Ũ�� d������H2��ѹ
e��������������ѹ f��������״�
��2����ͼ��ʾ���¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��H2�����������ѹǿ�仯���ߣ�A��C����ķ�Ӧ����AC�����������=����������ͬ����A��C����Ļ�ѧƽ�ⳣ��AC����״̬B��״̬A���ɲ����ķ���������¡����¡����� 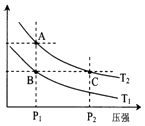
����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȵ����⣮��֪��CO ��g��+H2O ��g��H2 ��g��+CO2 ��g��ƽ�ⳣ��K���¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�ش���������
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H=0�������������������=����
��2������һ���¶��£�C��s��+CO2 ��g��2CO ��g��ƽ�ⳣ��K1��
C ��s��+H2O��g��CO��g��+H2 ��g��ƽ�ⳣ��K2��K��K1��K2 �� ֮��Ĺ�ϵ����
��3��800��ʱ����һ��10L�ĺ��ݷ�Ӧ���г���0.40molCO��1.60molˮ��������һ��ʱ���Ӧ�ﵽƽ�⣬��ʱCO��ת����Ϊ�������������������䣬��ƽ����ϵ����ͨ��0.10molCO��0.40molCO2 �� ��ʱv��v�� �����������=����������