题目内容
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程如下:

⑴Na2Cr2O7可由FeO·Cr2O3先氧化、再酸化得到。其中FeO·Cr2O3发生氧化反应的化学方程式为4FeO·Cr2O3+7O2+20NaOH![]() 8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
⑵“调节pH=4”后,溶液中c(Fe3+)=4×10-8 mol·L-1,则该温度下Ksp[Fe(OH)3]=______。
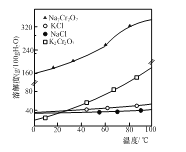
⑶已知部分物质的溶解度曲线如图所示。反应Ⅰ的化学反应类型为______。实验室由质量分数为10%的K2Cr2O7溶液获取K2Cr2O7晶体的方法是______。
⑷为测定K2Cr2O7样品纯度(杂质不参与反应),实验过程为:准确称量一定质量样品,与足量酸性KI 溶液充分反应后,用Na2S2O3标准溶液滴定生成的I2。实验过程中发生的物质转化关系分别为:Cr2O72-![]() Cr3+ S2O32-
Cr3+ S2O32-![]() S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
【答案】0.25 4×10-38 复分解反应 加热浓缩、降温结晶、过滤 1:6
【解析】
由流程可知,溶解后调节pH除去少量杂质Fe3+,过滤后蒸发结晶得到Na2Cr2O7,然后加入KCl发生Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,结合溶解度图可知,低温下K2Cr2O7的溶解度较小,则冷却结晶得到K2Cr2O7,以此解答该题。
(1)由4FeO·Cr2O3+7O2+20NaOH![]() 8Na2CrO4+4NaFeO2+10H2O,由Fe元素还原的O2的物质的量占1/(1+2×3)=1/7。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为7mol÷7÷4=0.25mol;
8Na2CrO4+4NaFeO2+10H2O,由Fe元素还原的O2的物质的量占1/(1+2×3)=1/7。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为7mol÷7÷4=0.25mol;
(2)“调节pH=4”后,pH=4时c(OH-)=10-10 mol·L-1溶液中c(Fe3+)=4×10-8 mol·L-1,则该温度下Ksp[Fe(OH)3]=4×10-8×(10-10)3=4×10-38。
(3)加入KCl发生反应Ⅰ:Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,结合溶解度图可知,低温下K2Cr2O7的溶解度较小,反应Ⅰ的化学反应类型为复分解反应。实验室由质量分数为10%的K2Cr2O7溶液为不饱和溶液,先变成饱和溶液,再冷却结晶,获取K2Cr2O7晶体的方法是加热浓缩、降温结晶、过滤。
(4)实验过程中发生的物质转化关系分别为:Cr2O72-![]() Cr3+ S2O32-
Cr3+ S2O32-![]() S4O62-,1molK2Cr2O7中Cr由+6降为+3价,共降6价,得6mol电子,1molNa2S2O3中S由+2价升为+2.5价,共升1价,失1mol电子,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=1:6。
S4O62-,1molK2Cr2O7中Cr由+6降为+3价,共降6价,得6mol电子,1molNa2S2O3中S由+2价升为+2.5价,共升1价,失1mol电子,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=1:6。

 举一反三期末百分冲刺卷系列答案
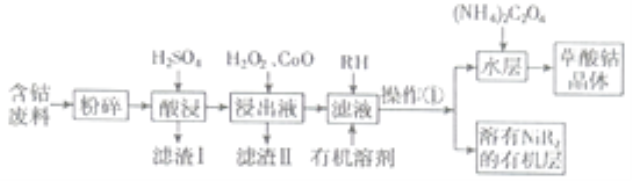
举一反三期末百分冲刺卷系列答案【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。用含钴废料(主要成分为![]() ,还含有一定量的
,还含有一定量的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等)制备草酸钴晶体
等)制备草酸钴晶体![]() 的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:
已知:①草酸钴晶体难溶于水
②![]() 为有机物(难电离)
为有机物(难电离)
③相关金属离子![]() 形成氢氧化物沉淀的
形成氢氧化物沉淀的![]() 范围如下:
范围如下:
金属离子 |
|
|
|
|
开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
(1)滤渣Ⅰ的成分_______。
(2)![]() 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入![]() 后溶液中发生的主要反应的离子方程式______。
后溶液中发生的主要反应的离子方程式______。
(3)加入氧化钴调节浸出液的![]() 的范围是______。
的范围是______。
(4)加入有机溶剂的目的是______。
(5)若仅从沉淀转化角度考虑,能否利用反应![]() 将
将![]() 转化为
转化为![]() ____(填“能”或“不能”),说明理由:______。(已知
____(填“能”或“不能”),说明理由:______。(已知![]() ,
,![]() )
)
(6)为测定制得的草酸钴晶体样品的纯度,现称取样品![]() ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液![]() 。移取
。移取![]() 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用![]() 高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液![]() ,计算草酸钴晶体样品的纯度为__________
,计算草酸钴晶体样品的纯度为__________![]() 。(用含
。(用含![]() 、
、![]() 、
、![]() 的代数式表示)(已知
的代数式表示)(已知![]() 的摩尔质量为
的摩尔质量为![]() )
)
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为_____。
(2)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
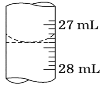
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为_____。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 25.10 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.21 | 25.22 |
(4)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______(保留四位有效数字)。
(5)下列哪些操作会使测定结果偏高_____ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)滴定达到终点的标志是________。
【题目】现有部分短周期元素的原子结构如下表:
元素编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:____________,元素Y的最简单氢化物的化学式为______________。
(2)Z元素原子的相对原子质量为____________。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________。
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为__________________。