题目内容
4.在一定温度下的密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表:| X | Y | Z | W | |
| 初始浓度/mol.L-1 | 1.0 | 2.0 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.4 | 0.2 | 1.2 | 0.6 |
| A. | 反应达到平衡时,Y的转化率为90% | |
| B. | 反应可表示为X(g)+3Y(g)═2Z(g)+W(g)平衡常数为280 L•mol-1 | |
| C. | 增大压强平衡向正反应方向移动,平衡常数不变 | |
| D. | 改变温度,平衡常数会随之改变 |
分析 A、根据转化率=$\frac{消耗量}{起始量}$×100%计算;
B、根据反应物浓度减小,生成物浓度增加,浓度的变化量之比等于计量数之比,确定化学方程式,根据平衡常数的定义计算平衡常数;
C、根据影响平衡移动及平衡常数的因素判断;
D、根据影响平衡常数的因素判断,平衡常数随温度变化.
解答 解:A、根据转化率=$\frac{消耗量}{起始量}$×100%可计算得X的转化率为$\frac{2.0-0.2}{2.0}$×100%=90%,故A正确;
B、根据表中数据可知,在反应中X减小0.6mol/L,Y减小1.8.mol/L,所以X、Y是反应物,Z增加了1.2mol/L,W增加了0.6mol/L,所以Z、W是生成物,X、Y、Z、W的浓度的变化量之比为1:3:2:1,所以化学方程式为X+3Y?2Z+W,平衡常数为$\frac{1.{2}^{2}×0.6}{0.4×0.{2}^{3}}$=270 L•mol-1,故B错误;
C、根据B得出的方程式可以判断,增大压强,平衡向正反应方向移动,平衡常数不变,故C正确;
D、对于某个反应来讲,平衡常数只与温度有关,温度改变,平衡常数也改变,故D正确;
故选B.
点评 本题主要考查转化率的计算、影响平衡常数的因素、化学方程式的确定及平衡常数的计算等知识点,难度不大.注重对基础知识的考查.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
19.下列实验中,依据实验操作及现象,得出的结论正确的是( )
| 操 作 | 现 象 | 结 论 | |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| C | 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或HCO3- |
| D | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
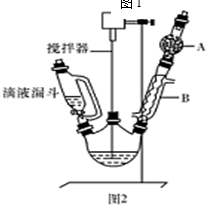
9.三苯甲醇是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
溴苯、乙醚溶液(40℃)苯甲酸乙酯、乙醚溶液、搅拌格氏试剂氯化铵饱和溶液镁条中间物三苯甲醇图1

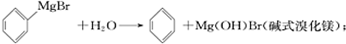
已知:(I)格氏试剂容易水解:
(Ⅱ)相关物质的物理性质如下:
(Ⅲ)三苯甲醇的相对分子质量是260.
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴 加热方式.
①溶解、过滤粗产品②洗涤、干燥三苯甲醇
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
溴苯、乙醚溶液(40℃)苯甲酸乙酯、乙醚溶液、搅拌格氏试剂氯化铵饱和溶液镁条中间物三苯甲醇图1


已知:(I)格氏试剂容易水解:

(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇,笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴 加热方式.
①溶解、过滤粗产品②洗涤、干燥三苯甲醇
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
16.常压下、120℃时,1体积某气态烃A和8体积足量的氧气混合点燃,充分燃烧后恢复到原来状况,混合气体的体积仍为9体积,则下列说法正确的是( )
| A. | 若A为单一气体,则不是甲烷就是乙烯 | |
| B. | 若A为单一气体,则可能是丙烷 | |
| C. | 若A为混合气体,则可能是甲烷,丙烯,乙炔按体积比2:1:1混合而成 | |
| D. | 若A为混合气体,则可能是乙烯,乙烷按质量比14:22混合而成室温时 |
13.下列实验操作不正确的是( )
| A. | 用量筒量取25.0mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3固体试样 | D. | 用托盘天平称量NaCl固体5.8g |
 $\stackrel{合适的氧化剂}{→}$
$\stackrel{合适的氧化剂}{→}$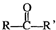 (注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
(注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
 .
. 或
或 .
.