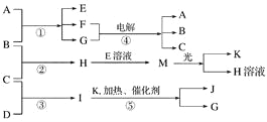
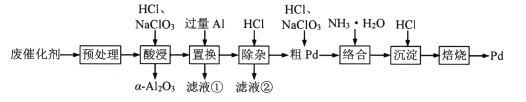
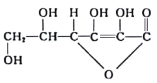
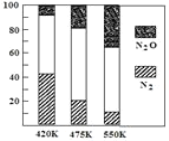
题目内容
【题目】下列说法不正确的是( )
A.不是所有的共价键都具有方向性
B.N≡N键能大于C≡C的键能,所以N≡N不易发生加成反应
C.根据价层电子对互斥理论可知,OF2分子的构型和H2O分子的构型相同
D.Na原子基态核外电子占有3个能层,4种能级,6个原子轨道,有6种电子运动状态
【答案】D
【解析】
A. 不是所有的共价键都具有方向性,如s-s δ键就没有方向性;
B. N≡N键能很大,所以N≡N很稳定,不易发生加成反应;
C. OF2分子的构型和H2O分子的构型都是V形;
D. Na原子基态核外电子占有3个能层,4种能级,6个原子轨道,有11种电子运动状态。
A. 不是所有的共价键都具有方向性,如s-s形成的δ键就没有方向性,A正确;
B. N≡N键能很大,所以N≡N很稳定,不易发生加成反应,B正确;
C. OF2分子中有2个δ键电子对,孤电子对数=![]() (6-1×2)=2,H2O分子中有2个δ键电子对,孤电子对数=
(6-1×2)=2,H2O分子中有2个δ键电子对,孤电子对数=![]() (6-1×2)=2,所以二者构型都是V形,C正确;
(6-1×2)=2,所以二者构型都是V形,C正确;
D. Na原子基态核外电子电子排布式为:1s22s22p63s1,所以Na占有3个能层,4种能级,6个原子轨道,每个原子轨道有两种不同的运动状态,因此有11种电子运动状态,D错误;
故合理选项是D。

练习册系列答案
相关题目