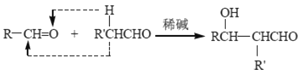
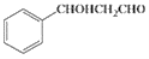
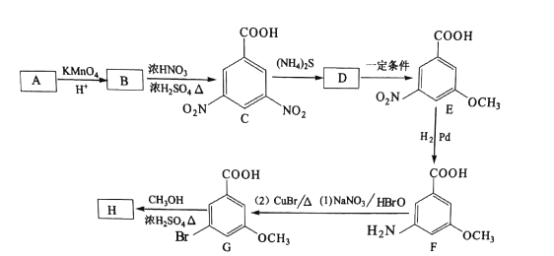
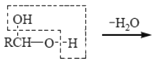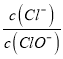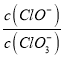题目内容
【题目】下列检验方法和结论正确的是
A.先加入稀盐酸,再滴加硝酸银溶液有白色沉淀生成,则原溶液中一定有Cl-
B.加入氯化钡溶液有白色沉淀生成,则原溶液中一定有SO![]()
C.加入浓NaOH溶液后加热,产生能使湿润的红色石蕊试纸变蓝色的气体,则原溶液中有NH4+
D.加入紫色石蕊试液,溶液显红色,证明溶液一定呈碱性
【答案】C
【解析】
A.盐酸中含有氯离子,故不能确定原溶液中有氯离子,应该先加入硝酸酸化,故A错误;
B.加入氯化钡溶液有白色沉淀生成,则原溶液中可能有SO42-、SO32-、Ag+、CO32-等,故B错误;
C.加入浓NaOH溶液后加热,产生能使湿润的红色石蕊试纸变蓝色的气体,说明生成的气体为NH3,则原溶液中有NH4+,故C正确;
D.加入紫色石蕊试液,溶液显红色,证明溶液一定显酸性,故D错误;
答案:C

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】某小组探究Br2、I2能否将Fe2+氧化,实验如下。
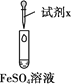
实验 | 试剂x | 现象及操作 |
| 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(1)实验ⅰ中产生Fe3+ 的离子方程式是________。
(2)以上实验体现出氧化性关系:Br2_______I2(填“>”或“<”)。
(3)针对实验ⅱ中未检测到Fe3+,小组同学I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验ⅲ:向ⅱ的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,_________(填操作和现象),证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
(5)针对上述现象,小组同学提出不同观点并对之进行研究。
① 观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:______。经证实观点1合理。
② 观点2:Fe3+ 可能由Ag+ 氧化产生。
实验ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填现象、操作),观点2合理。
(6)观点1、2虽然合理,但加入AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。设计实验:取ⅱ的黄色溶液,______(填操作、现象)。由此得出结论:不能充分说明(4)中产生Fe3+的原因是由反应a的平衡移动造成的。