题目内容
2011年9月29日,“长征-2F”运载火箭成功将“天宫一号”目标飞行器送上太空,火箭中使用的燃料是偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4).在火箭升空过程中,燃料发生反应:CH3-NH-NH-CH3+2N2O4→2CO2+3N2+4H2O提供能量.下列有关叙述正确的是( )
| A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染 |
| B.该反应中N2O4是还原剂,偏二甲肼是氧化剂 |
| C.CO2和N2都是还原产物 |
| D.每有0.6molN2生成,转移电子数目为3.2NA |
A.该反应中四氧化二氮能自发转化为二氧化氮,四氧化二氮、二氧化氮对环境都有污染,故A错误;
B.该反应中四氧化二氮得电子作氧化剂,偏二甲肼失电子是还原剂,故B错误;
C.该反应中二氧化碳是氧化产物,氮气既是氧化产物也是还原产物,故C错误;
D.该反应中每有0.6molN2生成,转移电子数目=0.6mol×
×(4-0)×2×NA/mol=3.2NA,故D正确;
故选D.
B.该反应中四氧化二氮得电子作氧化剂,偏二甲肼失电子是还原剂,故B错误;
C.该反应中二氧化碳是氧化产物,氮气既是氧化产物也是还原产物,故C错误;
D.该反应中每有0.6molN2生成,转移电子数目=0.6mol×
| 2 |
| 3 |
故选D.

练习册系列答案
相关题目

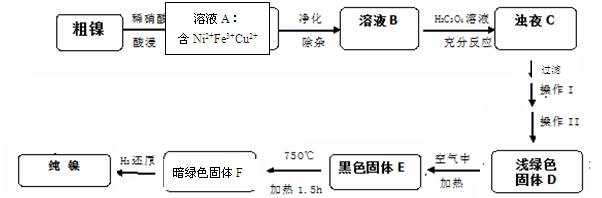
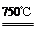 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑