题目内容
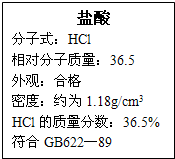
 右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:(1)求该浓盐酸的物质的量浓度.
(2)用上述浓盐酸和二氧化锰加热反应制取氯气,若生成氯气的体积在标准状况下为4.48L时,则被氧化的HCl的质量为多少克?
分析:(1)根据c=
计算盐酸的物质的量浓度;
(2)根据反应的化学方程式计算,方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,被氧化的盐酸是参加反应的盐酸的一半.
| 1000ρw |
| M |
(2)根据反应的化学方程式计算,方程式为:MnO2+4HCl(浓)
| ||
解答:解:(1)盐酸的物质的量浓度为c=
=
mol/L=11.8moL/L,
答:该浓盐酸的物质的量浓度为11.8mol/L;
(2)反应的方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
根据方程式计算:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
4×36.5g 22.4L
m 4.48L
m=
=29.2g,
根据方程式和化合价的变化情况可知,被氧化的盐酸是参加反应的盐酸的一半,
所以被氧化的HCl的质量为
=14.6g,
答:被氧化的HCl的质量为14.6g.
| 1000ρw |
| M |
| 1000×1.18×36.5% |
| 36.5 |
答:该浓盐酸的物质的量浓度为11.8mol/L;
(2)反应的方程式为MnO2+4HCl(浓)
| ||
根据方程式计算:
MnO2+4HCl(浓)
| ||
4×36.5g 22.4L
m 4.48L
m=
| 4×36.5g×4.48L |
| 22.4L |
根据方程式和化合价的变化情况可知,被氧化的盐酸是参加反应的盐酸的一半,
所以被氧化的HCl的质量为
| 29.2g |
| 2 |
答:被氧化的HCl的质量为14.6g.
点评:本题考查物质的量的有关计算,题目难度不大,本题注意被氧化的盐酸与参加反应的盐酸总物质的量的关系.

练习册系列答案
相关题目

 右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答: