题目内容
【题目】均三甲苯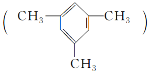 是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
(1)均三甲苯属于苯的同系物,选用一种试剂区别苯和均三甲苯:________________。
(2)均三甲苯分子中的一个H原子被Cl原子取代,所得产物有________种。
(3)下列属于苯的同系物的是________(填字母)。
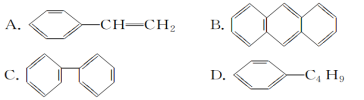
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是________(填字母)。
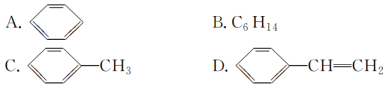
【答案】酸性高锰酸钾溶液 2 D D
【解析】
(1)、苯的同系物可被酸性高锰酸钾氧化;
(2)、判断等效氢的种类;
(3)、苯的同系物含有1个苯环,侧链为烷基,组成通式为CnH2n-6;
(4)、能发生加成、氧化、取代,由选项可知,含苯环和碳碳双键。
(1)、均三甲苯含有甲基,可被酸性高锰酸钾氧化,而苯与高锰酸钾不反应,故答案为:酸性高锰酸钾溶液;
(2)、均三甲苯分子中3个甲基上的H等效,3个没有取代基的碳原子上的H也等效,因此共有两种一氯代物,故答案为:2;
(3)、苯的同系物分子中只有一个苯环,且侧链均为烷基,满足条件的只有D项;故答案为:D。
(4)能发生加成、氧化、取代,由选项可知,含苯环和碳碳双键,只有选项D符合,故答案为:D。

【题目】用如图所示装置检验乙烯时不需要虚线框中除杂装置的是( )
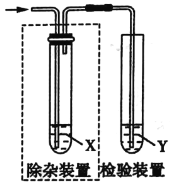
选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | I2的CCl4溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | I2的CCl4溶液 |
A.AB.BC.CD.D
【题目】甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知 ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH= + 93.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③甲醇的燃烧热为726.51kJ·mol-1。
要写出表示甲醇燃烧热的热化学方程式,还缺少的热化学方程式为________________。
(2)甲醇可采用煤的气化、液化制取(CO+2H2CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图所示。
的关系如图所示。
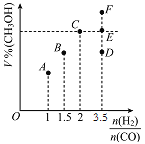
①当起始![]() =2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
=2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
A.<![]() B.=
B.=![]() C.
C.![]() ~
~ ![]() D.=
D.=![]() E.>
E.> ![]()
②当![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
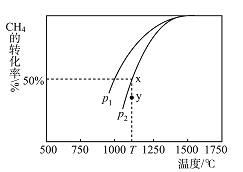
(3)制甲醇的CO和H2可用天然气来制取:CO2(g)+CH4(g)2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol·L1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH______(选填“大于”“小于”或“等于”)0。压强p1_______(选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)__________(选填“大于”“小于”或“等于”)v(逆)。若p2=6Mpa,则T℃时该反应的平衡常数Kp=_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) [反应Ⅰ]。
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最高的反应所用的催化剂是____(填“A”、“B”或“C”)。

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应CO2(g)+H2(g)CO(g)+H2O(g)[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_________。