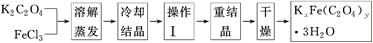
题目内容
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为 :用化学式表示一种由B、C、E组成的物质 。
(2)B的氢化物比E的氢化物的沸点 (填“高”或“低”),理由是 。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式 。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。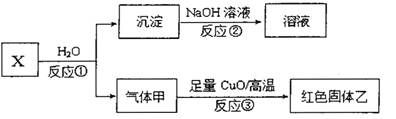
i.写出反应①的化学方程式 。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式 。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分 。
(1) Na2SO4、Na2SO3 、Na2S2O3(写出其中一种)
Na2SO4、Na2SO3 、Na2S2O3(写出其中一种)
(2)高 水分子间存在氢键 (3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3―
(4) Al4C3+12H2O=4Al(OH)3↓+3CH4↑; CH4 + 4CuO高温4Cu+CO2+2H2O
(5)将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体
解析试题分析:A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍,则A可能是碳元素或硫元素,由于A的原子序数最小,因此A应该是碳元素;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,因此一定是氢氧化铝与酸碱的反应,则D是铝,C是钠,B是氧元素,E是硫元素。
(1)B的双原子阴离子是过氧根离子,电子式为 :由B、C、E组成的物质有Na2SO4、Na2SO3 、Na2S2O3。
:由B、C、E组成的物质有Na2SO4、Na2SO3 、Na2S2O3。
(2)由于水分子间存在氢键,所以B的氢化物比E的氢化物的沸点高。
(3)B、C、D组成化合物是偏铝酸钠,其水溶液与过量二氧化碳反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3―。
(4)气体甲是天然气的主要成分,则甲是甲烷。X与水反应生成甲烷和沉淀,沉淀能溶于氢氧化钠,应该是氢氧化铝沉淀,则X中含有铝元素,因此X是碳化铝,化学式为Al4C3,碳化铝与水反应的化学方程式为Al4C3+12H2O=4Al(OH)3↓+3CH4↑。若红色固体乙是一种单质,则该单质是铜,这说明甲烷与氧化铜发生了氧化还原反应生成铜、二氧化碳和水,则反应③的化学方稈式CH4 + 4CuO高温4Cu+CO2+2H2O。
(5)二氧化碳、二氧化硫均能使澄清石灰水变浑浊,但二氧化硫还具有还原性和漂白性,据此检验即可,即将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体。
考点:考查元素、无机框图题推断、氧化还原反应以及气体检验实验方案设计

 通城学典默写能手系列答案
通城学典默写能手系列答案某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操 作 | 现 象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH | pH试纸变红(约为4) |
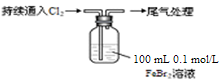 | ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
| 试管 | 操作 | 现象 | 结论 |
| a | 取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | | Cl2的氧化性强于Fe3+ |
| b | 取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到的KMnO4溶液贮存于棕色试剂瓶并放在暗处;④利用氧化还原滴定方法,用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度,KMnO4在滴定中被还原成Mn2+。请回答下列问题:
(1) 准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(2) 在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________(填序号)。
| A.质量分数为30%的双氧水 | B.FeSO4 | C.摩尔盐 | D.Na2SO3 |
(4) 采用H2C2O4·2H2O做基准试剂的氧化还原滴定在室温时反应很慢,所以反应需要在70~80 ℃条件下进行,但温度更高会导致草酸分解产生气体,写出草酸分解的化学反应方程式 ,若如此所测得的高锰酸钾标准液浓度会 (填“偏高”、“偏低”或“无影响”)。即使控制70~80 ℃条件,一开始滴定时反应仍然较慢,若滴加KMnO4溶液过快的话,会造成KMnO4溶液浓度局部过高而分解,因此在开始几滴操作时应 ,在滴入几滴KMnO4溶液之后,反应速率会迅速加快,该滴定操作也可相应加快,反应速率加快的原因是 。
(5)若用放置两周后的KMnO4标准溶液去测定水样中Fe2+的含量,测得的Fe2+浓度值将________(填“偏高”、“偏低”或“无影响”)。
用下图所示装置不能达到有关实验目的是
| A.用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水) |
| B.用乙图装置制备Fe(OH)2 |
| C.用丙图装置制取金属锰 |
| D.用丁图装置比较NaHCO3和Na2CO3的热稳定性 |