题目内容
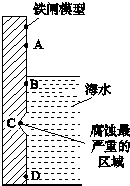
16.(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.①该电化腐蚀称为吸氧腐蚀
②正极的电极反应式为O2+4e-+2H2O═4OH-.
③图中A、B、C、D四个区域,生成铁锈最多的是B(填字母).
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol•L-1.现抽取某人血样10ml.稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3mol•L-1 KMnO4溶液与溶解得到的草酸恰好完全反应.据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常.
(提示2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3mol•L-1 KMnO4 220mL溶液,需要称取KMnO4固体的质量是0.197g;
使用的容量瓶为250mL;
②每消耗草酸1.0mol,转移电子的物质的量为2mol;
③通过计算可判断,此人血液中的Ca2+的浓度正常(填“是”或“否”正常.
分析 (1)①由图可知,海水溶液为弱酸性,发生吸氧腐蚀;
②正极氧气得到电子生成氢氧根离子,据此写出电极反应式;
③中性或弱酸性条件下,铁发生吸氧腐蚀,铁接触空气、水时腐蚀最严重;
(2)配制5.0×10-3mol•L-1 KMnO4 220mL溶液,需要配制250mL该溶液,则应该选用250mL容量瓶,根据n=cV计算出高锰酸钾的物质的量,再根据m=nM计算出其质量;
②根据反应可知草酸中C元素的化合价由+3价升高为+4价,则每消耗草酸1mol,转移电子的物质的量为:1mol×2×(4-3)=2mol;
③消耗高锰酸钾的物质的量为:5.0×10-3mol/L×0.002L=1×10-5mol,由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O、5H2C2O4~5CaC2O4可知,草酸钙的物质的量为1×10-5mol×52=2.5×10-5mol,血液中钙离子物质的量为2.5×10-5mol,根据c=nV计算出钙离子浓度,再根据正常人钙离子浓度判断此人钙离子浓度是否正常.
解答 解:(1)①由图可知,海水溶液为弱酸性,则Fe失去电子,正极上氧气得到电子,发生吸氧腐蚀,
故答案为:吸氧腐蚀;
②钢铁吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为:O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-;
③海水溶液呈中性,则钢铁发生吸氧腐蚀,钢铁接触空气、水时腐蚀最严重,所以B处腐蚀最严重,
故答案为:B;
(2)①配制5.0×10-3mol•L-1 KMnO4 220mL溶液,需要选用规格为250mL的容量瓶配制250mL该浓度的溶液,则称取KMnO4固体的质量是:0.25L×5.0×10-3mol•L-1×158g/mol=0.197g,
故答案为:0.197;250;
②由反应可知,草酸中C元素的化合价由+3价升高为+4价,则每消耗草酸1mol,转移电子的物质的量为:1mol×2×(4-3)=2mol,
故答案为:2;
③消耗高锰酸钾的物质的量为:5.0×10-3mol/L×0.002L=1×10-5mol,由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O及5H2C2O4~5CaC2O4可知,草酸钙的物质的量为:1×10-5mol×52=2.5×10-5mol,血液中钙离子物质的量为2.5×10-5mol,浓度为2×10−50.01Lmol=2.5×10-3mol/L,正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol•L-1,所以此人血液正常,
故答案为:正常.
点评 本题考查了氧化还原反应的计算、金属的腐蚀与防护,题目难度中等,试题考查较综合,注意掌握原电池工作原理及其应用,能够正确书写电极反应式,明确氧化还原反应的计算方法.

 阅读快车系列答案
阅读快车系列答案| A. | 通入品红溶液中 | B. | 用带火星的木条检验 | ||
| C. | 通入澄清石灰水中 | D. | 通入石蕊溶液中 |
 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )| A. | ⑤⑥⑦ | B. | ④⑨⑩ | C. | ⑪⑫⑬ | D. | ①②③⑧ |
| A. | CCl4 | B. | CH2Cl2 | C. | NH3 | D. | H2O |
| A. | PVC保鲜膜属于链状聚合物,在高温时易熔化 | |
| B. | PVC的单体不能由PE的单体与氯化氢加成制得 | |
| C. | 鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE | |
| D. | 等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多 |


 ,名称是环己烷.
,名称是环己烷.
 ,B的结构式为
,B的结构式为 .
.