题目内容
(1)①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2,SO2吸收Br2的离子方程式是 .
②在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 ( 填序号).
A.40.32L B.30.24L C.20.16L D.13.44L
③除去NO中的NO2所用的试剂 (填写化学式).
(2)某溶液中可能含有NH4+,Ba2+,Mg2+,Ag+,OH-,SO42-,CO32-中的某几种,现用该溶液做以下实验:①取此溶液少许,加入足量盐酸无明显现象;②另取少许加入足量浓氢氧化钠溶液,有白色沉淀生成;③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝.
①由此推断,该溶液中肯定有离子 ,肯定无离子 .
②写出有关反应的离子方程式 .
②在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.13.44L
③除去NO中的NO2所用的试剂
(2)某溶液中可能含有NH4+,Ba2+,Mg2+,Ag+,OH-,SO42-,CO32-中的某几种,现用该溶液做以下实验:①取此溶液少许,加入足量盐酸无明显现象;②另取少许加入足量浓氢氧化钠溶液,有白色沉淀生成;③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝.
①由此推断,该溶液中肯定有离子
②写出有关反应的离子方程式
考点:二氧化硫的化学性质,氮的氧化物的性质及其对环境的影响,浓硫酸的性质,物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题,元素及其化合物
分析:(1)①SO2吸收Br2反应生成硫酸和HBr;
②铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O;
③二氧化氮与水反应生成NO;
(2)①取此溶液少许,加入足量盐酸无明显现象,说明溶液中不存在银离子、碳酸根离子;
②另取少许加入足量浓氢氧化钠溶液,有白色沉淀生成,说明溶液中一定存在镁离子,一定不会存在碳酸根离子、氢氧根离子;
③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,溶液中一定存在铵离子,一定不会存在氢氧根离子,再根据溶液呈电中性判断,溶液中一定存在硫酸根离子,一定不会存在钡离子.
②铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓)
| ||
③二氧化氮与水反应生成NO;
(2)①取此溶液少许,加入足量盐酸无明显现象,说明溶液中不存在银离子、碳酸根离子;
②另取少许加入足量浓氢氧化钠溶液,有白色沉淀生成,说明溶液中一定存在镁离子,一定不会存在碳酸根离子、氢氧根离子;
③将②中沉淀过滤,取滤液微热,有无色刺激性气味气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,溶液中一定存在铵离子,一定不会存在氢氧根离子,再根据溶液呈电中性判断,溶液中一定存在硫酸根离子,一定不会存在钡离子.
解答:
解:(1)①SO2吸收Br2反应生成硫酸和HBr,离子反应为SO2+Br2+2H2O=4H++SO42-+2Br-,故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
②铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O,浓硫酸的物质的量为0.1L×18mol/L=1.8mol,如被还原的硫酸是0.9mol,则生成n(SO2)=0.9mol,V(SO2)=0.9mol×22.4L/mol=20.16L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于20.16L,只有D符合,故答案为:D;
③二氧化氮与水反应生成NO,则除去NO中的NO2所用的试剂为H2O,故答案为:H2O;
(2)由①可知,加盐酸无现象,溶液中不存在Ag+、CO32-;
由②可知溶液中一定存在Mg2+,一定不会存在与镁离子反应的离子:OH-、CO32-;
由③可知,生成的气体为氨气,溶液中一定存在NH4+,
再根据溶液呈电中性可知,溶液中一定存在阴离子SO42-,则一定不存在与硫酸根离子反应的离子Ba2+,
①根据以上分析可知,该溶液中一定存在的离子有:NH4+、Mg2+ SO42-;一定不存在的离子为:Ba2+、Ag+ OH-、CO32-,
故答案为:NH4+、Mg2+ SO42-;Ba2+、Ag+ OH-、CO32-;
②以上信息中存在的反应有:镁离子与氢氧根离子生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
铵离子与氢氧根离子反应生成一水合氨,反应的离子方程式为NH4++OH-
NH3↑+H2O,
故答案为:Mg2++2OH-=Mg(OH)2↓、NH4++OH-
NH3↑+H2O.
②铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓)
| ||
③二氧化氮与水反应生成NO,则除去NO中的NO2所用的试剂为H2O,故答案为:H2O;
(2)由①可知,加盐酸无现象,溶液中不存在Ag+、CO32-;
由②可知溶液中一定存在Mg2+,一定不会存在与镁离子反应的离子:OH-、CO32-;
由③可知,生成的气体为氨气,溶液中一定存在NH4+,
再根据溶液呈电中性可知,溶液中一定存在阴离子SO42-,则一定不存在与硫酸根离子反应的离子Ba2+,
①根据以上分析可知,该溶液中一定存在的离子有:NH4+、Mg2+ SO42-;一定不存在的离子为:Ba2+、Ag+ OH-、CO32-,
故答案为:NH4+、Mg2+ SO42-;Ba2+、Ag+ OH-、CO32-;
②以上信息中存在的反应有:镁离子与氢氧根离子生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
铵离子与氢氧根离子反应生成一水合氨,反应的离子方程式为NH4++OH-
| ||
故答案为:Mg2++2OH-=Mg(OH)2↓、NH4++OH-
| ||
点评:本题考查较综合,涉及二氧化硫的性质及离子的检验、物质除杂等,为高频考点,把握二氧化硫的还原性及常见离子之间发生的反应现象及离子检验的方法,明确某些离子的特征反应,题目难度中等.

练习册系列答案
相关题目
下列有关电池的说法不正确的是( )
| A、手机上用的锂离子电池属于二次电池 |
| B、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C、甲醇燃料电池可直接把化学能转化为电能 |
| D、铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-═PbO2+SO42-+4H+ |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1mol?L-1的甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、甲酸与盐酸都能与NaOH发生反应 |
| D、甲酸溶液的导电能力比盐酸溶液的导电能力弱 |
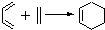 .
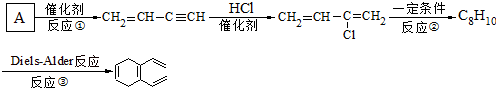
.
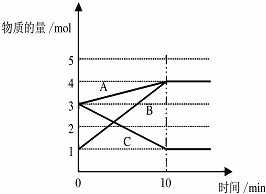 (1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
(1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.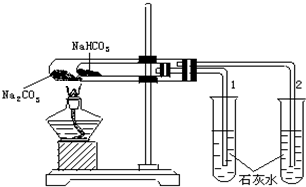 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: