题目内容
16.下列各组性质比较中,正确的是( )①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O
④氧化性:Li+<Na+<K+
⑤气态氢化物溶于水后的酸性:HCl>HF.
| A. | ①②③ | B. | ②③④ | C. | ①②⑤ | D. | ①②④⑤ |
分析 ①非金属性越弱,对应的最高价氧化物的水化物的酸性越弱;
②同主族元素的金属性越强,对应的最高价氧化物的水化物的碱性越强:
③同周期从左到右非金属性增强;
④金属性越强,对应氧化性的氧化性越弱;
⑤非金属性越强,对应的氢化物越稳定,氢化物越难电离,水溶液酸性越弱.
解答 解:①Cl、Br、I位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱,所以酸性:HClO4>HBrO4>HIO4
,故①正确;
②同主族元素的金属性从上到下逐渐增强,对应的最高价氧化物的水化物的碱性增强,所以碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,故②正确;
③同周期从左到右非金属性增强,所以非金属性:F>O>C,故③错误;
④金属性越强,对应氧化性的氧化性越弱,所以氧化性Li+>Na+>K+,故④错误;
⑤非金属性越强,对应的氢化物越稳定,氢化物越难电离,水溶液酸性越弱,酸性:HCl>HF,故⑤正确;
故选C.
点评 本题考查元素周期表的递变规律,题目难度不大,注意单质、化合物的性质与金属性、非金属性的关系.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
17.实验室蒸发NaCl溶液时,一般有以下操作过程:其正确的操作顺序为( )
①固定铁圈位置 ②加热蒸发,并不断搅拌③放置酒精灯④将蒸发皿放置在铁圈上⑤停止加热,利用余热蒸干.
①固定铁圈位置 ②加热蒸发,并不断搅拌③放置酒精灯④将蒸发皿放置在铁圈上⑤停止加热,利用余热蒸干.
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ③①④②⑤ | D. | ⑤④③②① |
18.下列叙述,正确的是( )
| A. | 电解质在电流的作用下发生电离 | |
| B. | 存在自由移动的离子是电解质溶液能导电的原因 | |
| C. | 金属铜能导电,所以铜是电解质 | |
| D. | 硫酸氢钠在水溶液中能电离出氢离子,所以硫酸氢钠属于酸 |
4.对于下列甲、乙、丙三物质的说法,不正确的是( )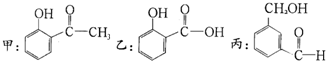

| A. | 等物质的量的甲、乙、丙分别与足量钠反应,乙放出气体最多 | |
| B. | 甲、乙、丙均能与Fe3+显色 | |
| C. | 甲和丙互为同分异构体 | |
| D. | 甲、乙、丙苯环上的一溴代物均为4种 |
11.往10mL 1mol/L AlCl3加入1mol/L NaOH溶液,得沉淀0.39g,则所加氢氧化钠溶液的体积可能为( )
| A. | 5 mL | B. | 25 mL | C. | 35 mL | D. | 45mL |
1.下列叙述正确的是( )
| A. | 只含有共价键的物质都是共价化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 凡是在水溶液中能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中一定没有共价键 |
8.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | 8NH3+3Cl2═6NH4Cl+N2 | B. | Cl2+2HI═I2+2HCl | ||
| C. | 2Na2O2+2H2O═4NaOH+O2 | D. | Ca(OH)2+2HCl═CaCl2+2H2O |
5.实验室里做钠跟水反应的实验时,用到的仪器和药品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤烧杯 ⑥石棉网⑦玻璃片 ⑧药匙.
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤烧杯 ⑥石棉网⑦玻璃片 ⑧药匙.
| A. | ①②③④ | B. | ②③④⑤⑦ | C. | ①③④⑥⑧ | D. | ②⑤⑥⑦⑧ |
6.下列叙述正确的是( )
| A. | 25℃时,溶液中由水电离的c(H+)=1.0×10-4mol/L,则该溶液有可能是稀盐酸 | |
| B. | NH4Cl溶液加水稀释后,恢复至原温度,pH和Kw均增大 | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 在Na2S溶液中加入AgCl固体,白色AgCl转变为黑色Ag2S,则溶液中c(S2-)下降 |