题目内容
【题目】在容积为![]() L的密闭容器内,物质D在
L的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
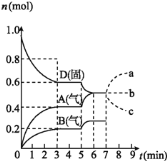
A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
![]()
B.根据如图该反应的平衡常数表达式为![]()
C.若在第5min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线
【答案】D
【解析】
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为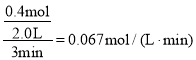 ,B的变化量是A的一半,所以
,B的变化量是A的一半,所以![]()
![]() ,故A正确,但不符合要求;
,故A正确,但不符合要求;
B. 根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,![]() 时,
时,![]() ,
,![]() ,
,![]() ,
,![]() :
:![]() :
:![]() :
:![]() :
:![]() :4:2,方程式为:
:4:2,方程式为:![]() ;因D为固体,所以化学平衡常数
;因D为固体,所以化学平衡常数![]() ,故B正确,但不符合要求;
,故B正确,但不符合要求;
C. 温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大;温度升高化学反应B的反应速率加快,故C正确,但不符合要求;
D. D为固体,增加D的物质的量,浓度不变,平衡不移动,A的物质的量变化情况符合b曲线,故D错误;
故选:D。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
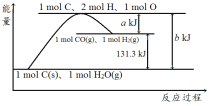
Ⅰ.已知H—H键的键能为a kJ·mol-1,N—H键的键能为bkJ·mol-1,N![]() N键的键能是ckJ·mol-1,则反应NH3(g)
N键的键能是ckJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1=____(用K表示)。
2NH3(g)的平衡常数K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),该反应的ΔH___0(填“>”或“<”)。
②该反应自发行的条件是____(填高温、低温、任何温度)。
③对该反应,下列说法正确的是___(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D.反应达到平衡后,其他条件不变,在原容器中按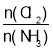 =1继续充入一定量反应物,达新平衡后Cl2的转化率增大
=1继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
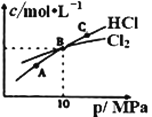
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式____。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=____。