题目内容
下列物质转化在给定条件下能实现的是
①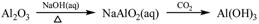
②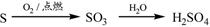
③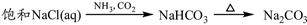
④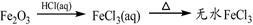
⑤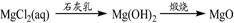
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
A
解析试题分析:氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水。向偏铝酸钠溶液中通入CO2生成氢氧化铝白色沉淀,①正确;单质硫燃烧生成二氧化硫,得不到三氧化硫,②不正确;向饱和的氯化钠溶液中通入氨气,然后再通入CO2即生成碳酸氢钠。碳酸氢钠不稳定加热分解生成碳酸钠、水和CO2,该反应是侯氏制碱法原理,③正确;氧化铁是碱性氧化物,与盐酸反应生成氯化铁和水。由于铁离子在溶液中水解生成氢氧化铁和氯化氢,水解吸热,加热氯化铁溶液促进水解,且生成的氯化氢易挥发,所以最终得到氢氧化铁晶体,得不到无水氯化铁,④不正确;氯化镁与石灰乳反应生成氢氧化镁白色沉淀,氢氧化镁煅烧分解生成氧化镁和水,⑤正确,答案选A。
考点:考查物质转化的有关判断

某固体物质和某溶液在一定条件下反应,产生气体(恢复至常温)的平均相对分子质量为45.8,则发生反应的物质不可能是
| A.Zn和浓H2SO4 | B.C和浓HNO3 |
| C.Cu和浓HNO3 | D.Na2O2和NH4Cl浓溶液 |
下列叙述不正确的是( )
| A | B | C | D |
 |  |   |  |
| 闪电时会发生反应: N2 + O2  2NO 2NO | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中
②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入足量CO2
| A.只有②③④⑤ | B.只有①②⑤ | C.只有②③⑤ | D.全部 |
如图所示,夹子开始处于关闭状态,将液体A滴人烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体 A和气体B的组合不可能是
| A.水、氯化氢 |
| B.硫酸、氨气 |
| C.氢氧化钠溶液、二氧化硫 |
| D.氢氧化钠溶液、一氧化碳 |
下列推断正确的是( )
| A.SiO2虽是酸性氧化物,但其不溶于水,因此不能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同 |
| C.CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在 |
| D.新制氯水显酸性,因此向其中滴加少量紫色石蕊试液,充分振荡后溶液最终会呈红色 |
用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊。 | Ca(OH)2溶液 |
常温下,下列不发生反应的一组物质是( )
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱
⑤铁与液氯 ⑥一氧化氮与氧气 ⑦硅与氧气 ⑧H2S与SO2
| A.①②③⑥ | B.②③⑥⑧ | C.①④⑤⑦ | D.①②③⑦ |
下列推断正确的是( )
| | 事实 | 结论 |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜均与浓硫酸不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 可用饱和 Na2CO3溶液除去 CO2中的少量HCl |
| C | 氧化铜高温下生成红色物质,该物质可与稀硫酸反应 | 氧化铜高温下可分解生成Cu2O |
| D | 稀、浓HNO3分别与铜反应,还原产物分别为NO和NO2 | 稀 HNO3氧化性比浓 HNO3强 |