题目内容
己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/moL;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/moL.则HCN在水溶液中电离的△H等于( )
| A.-67.7kJ/moL | B.-43.5kJ/moL |
| C.+43.5kJ/moL | D.+67.7kJ/moL |
反应的热化学方程式分别为:
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJ?mol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ?mol-1…②
用①-②可得HCN电离的热化学方程式为:HCN(aq)
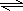
H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
故选:C.
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJ?mol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ?mol-1…②
用①-②可得HCN电离的热化学方程式为:HCN(aq)
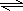
H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
故选:C.

练习册系列答案
相关题目