题目内容
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案: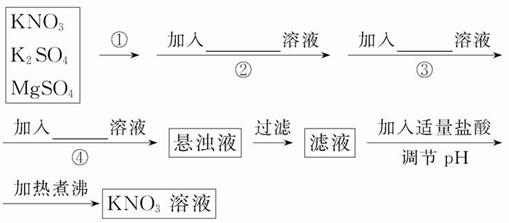
(1)操作①为___________________________。
(2)操作②~④加入的试剂依次可以为:___________________________________________________。
(3)如何判断SO42-已除尽?____________________________。
(4)实验过程中产生的多次沉淀_______ (填“需要”或“不需要”)多次过滤,其理由是_______________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由:___________________________________。
(1)加水溶解
(2)Ba(NO3)2、K2CO3、KOH或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3
(3)静置,在上层澄清溶液中再加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽
(4)不需要 几个沉淀反应互不干扰,因此最后只过滤一次,可减少操作程序
(5)不严密,因为加入盐酸调节溶液的pH会引进Cl-,应加入稀硝酸
解析

下列实验现象或结论错误的是
| 选项 | 实 验 | 现象或结论 |
| A | 取少量某溶液,滴加过量的稀盐酸无明显现象,再滴加BaCl2溶液 | 出现白色沉淀,则该溶液中含有SO42- |
| B | 相同温度下,取两份等质量的锌粒分别与足量稀酸反应,向其中一份中加入几滴CuSO4溶液 | 加入ZnSO4溶液的产生氢气快,最终二者生成氢气的量相同 |
| C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D | 向Na2S溶液中滴入ZnSO4溶液有白色沉淀生成,再加入几滴ZnSO4溶液 | 沉淀由白色转化为黑色,说明溶度积(Ksp):ZnS>CuS |
由于易被氧化而不宜长期存放的溶液是
| A.氢硫酸 | B.硫酸钠溶液 | C.漂白粉 | D.浓硫酸 |
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③100mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为
(3)有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们,并贴上标签。
| | 操 作 步 骤 | 现 象 及 结 论 |
| 方法一 | | |
| 方法二 | | |
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: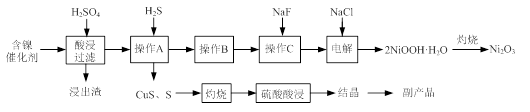
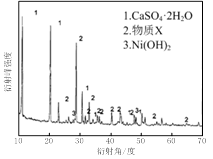
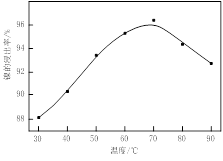
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。