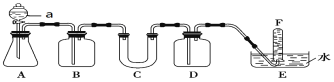
题目内容
【题目】Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有 _____个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有____种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为____。
(3) H2Se属于____(填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为______。
(4) SeO2的立体构型为____。SeO3中Se原子的杂化形式为____。
(5)写出一种与SeO42-互为等电子体的分子式____.
(6)Se能与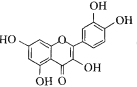 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol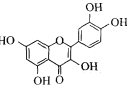 中含有σ键的数目为 ___。
中含有σ键的数目为 ___。
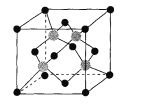
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏加德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为 ___。(列出计算式即可)
【答案】9 2 Br>As>Se 极性 H2Se形成的晶体属于分子晶体,NaH形成的晶体为离子晶体 V形 sp2 CX4、SiX4(X代表卤原子)等中的一种 34 NA ![]() g/mol
g/mol
【解析】
(1)Se的原子序数为34,位于元素周期表第四周期VIA族,其所有能层的p能级电子云轮廓图形状均为哑铃形;基态原子核外价电子排布式为4s24p4,其未成对电子数为2,据此作答;
(2)同周期中,元素的第一电离能呈增大趋势,IIA与VA族元素最外层电子排布处于全充满和半充满状态,所以会比同周期后一族元素的第一电离能大;
(3)H2Se属于分子化合物,从键的极性与分子的立体构型判断分子的极性;熔沸点的大小可以从物质所属的晶体类型分析判断,一般情况下,分子晶体的熔沸点低于离子晶体的熔沸点;
(4)依据价层电子对互斥理论和杂化轨道理论分析作答;
(5)等电子体是指原子总数相同,价层电子总数相同的分子或离子;可通过相邻元素或相邻族的元素替换并调整电荷数来寻找等电子体;
(6)在该化合物中,一个苯环中含6个C-Cσ键和6个C-Hσ键,一个单键或双键中分别含1个σ键,据此计算;
(7)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,该晶胞中含有硒原子数为8×![]() +6×
+6×![]() = 4,含有锌原子数为4,根据ρ=
= 4,含有锌原子数为4,根据ρ= ![]() 可计算出晶胞的质量,进而确定其摩尔质量;
可计算出晶胞的质量,进而确定其摩尔质量;
(1)Se的原子序数为34,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p4,因各能层的p能级原子轨道数有3个,所以基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有3+3+3 = 9个,因为基态Se原子核外价电子排布式为4s24p4,电子未成对电子数为2,在第四周期过渡金属中,基态原子核外未成对电子数为2的有Ti和Ni共2种元素,
故答案为:9;2;
(2)与Se同周期相邻的元素为第VA族的As和第VIIA的Br元素,因周期中,第一电离能虽原子序数的增加呈增大趋势,则Br的第一电离能最大,又因为As处于第VA族,核外电子排布4p能级处于半充满状态,稳定结构,故其第一电离能比Se的大,所以三者第一电离能从大到小顺序为:Br>As>Se,
故答案为:Br>As>Se;
(2)H2Se分子内为极性共价键,根据价层电子对互斥理论可知,该分子价层电子对数为4,有2对孤电子对,则其分子的立体构型为V形,极性键的极性向量和不等于零,所以该分子为极性分子,又因为NaH形成的晶体为离子晶体,而H2Se形成的晶体属于分子晶体,所以其熔沸点较NaH低,
故答案为:H2Se形成的晶体属于分子晶体,NaH形成的晶体为离子晶体;
(4)根据价层电子对互斥理论可知,SeO2的Se的孤电子对数为2,![]() 键电子对数为2,所以价层电子对数 = 2+2 =4,其分子的VSEPR模型为四面体形,分子的空间立体构型为V形,SeO3中Se原子的杂化轨道数 = 3+0= 3,所以采用的杂化方式为sp2,
键电子对数为2,所以价层电子对数 = 2+2 =4,其分子的VSEPR模型为四面体形,分子的空间立体构型为V形,SeO3中Se原子的杂化轨道数 = 3+0= 3,所以采用的杂化方式为sp2,
故答案为:V形;sp2;
(5)SeO42-的原子总数为5,价层电子总数为6+6×4+2 = 32,与SeO42-互为等电子体的分子可以是CX4、SiX4(X代表卤原子)等中的一种,
故答案为:CX4、SiX4(X代表卤原子)等中的一种;
(6)根据上述分析可知,1 mol 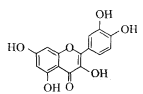 分子中σ键数目等于共价键数,所以σ键数目总数 = 2×12 mol(苯环上) + 5×1 mol(酚羟基) +5×1 mol(杂环)= 34 mol,
分子中σ键数目等于共价键数,所以σ键数目总数 = 2×12 mol(苯环上) + 5×1 mol(酚羟基) +5×1 mol(杂环)= 34 mol,
故答案为:34 NA;
(7)设硒化锌的摩尔质量为M,该晶胞中该晶胞中含有硒原子数为8×![]() +6×
+6×![]() = 4,含有锌原子数为4,其化学式可表示为ZnSe,根据晶胞中ρ=
= 4,含有锌原子数为4,其化学式可表示为ZnSe,根据晶胞中ρ= ![]() 可得,ρ=
可得,ρ= ![]() ,化简整理得 M=
,化简整理得 M= ![]() g/mol,
g/mol,
故答案为:![]() g/mol。
g/mol。

 阅读快车系列答案
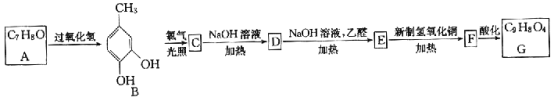
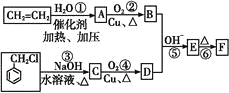
阅读快车系列答案【题目】【有机化学基础】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
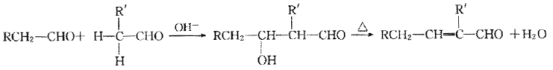
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+![]()
![]()
![]()
请回答:
(1)D的结构简式为 ;检验其中官能团的试剂为 。
(2)反应①~⑥中属于加成反应的是 (填序号)。
(3)写出有关反应③的化学方程式: 。
(4)在实验室里鉴定(![]() )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是 (请按实验步骤操作的先后次序填写序号)。
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是 (请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 | B.加NaOH溶液 | C.加热 | D.用稀硝酸酸化 |
(5)下列关于E的说法正确的是 (填字母)。
a.能与银氨溶液反应 b.能与金属钠反应
c.1 mol E最多能和3 mol氢气反应 d.可以发生水解
(6)E的同分异构体有多种,其中之一甲符合条件:①苯环上只有一个取代基,②属于酯类,可由H和芳香酸G制得,现测得H分子的红外光谱和核磁共振氢谱如下图:(已知H的相对分子量为32)则甲的结构简式为
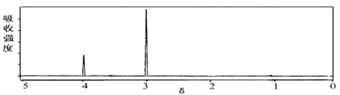
未知物H的核磁共振氢谱

未知物H的红外光谱