题目内容
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1molOH-与1mol-OH所含质子数均为9NA | |
| B. | 0.1mol/L的CuCl2溶液中含Cl-的数目为0.2 NA | |
| C. | 标准状况下,11.2LCCl4中含C-C键的数目为2NA | |
| D. | 10 mL 2mol/LH2O2完全分解,转移的电子数为0.2 NA |
分析 A、氢氧根和羟基中均含9个质子;
B、溶液体积不全面;
C、标况下四氯化碳为液态;
D、双氧水的分解为歧化反应.
解答 解:A、氢氧根和羟基中均含9个质子,故1mol氢氧根和1mol-OH中均含NA个质子,故A正确;
B、溶液体积不全面,故溶液中的氯离子的个数无法计算,故B错误;
C、标况下四氯化碳为液态,故物质的量无法根据气体摩尔体积来计算,故C错误;
D、双氧水的分解为歧化反应,1mol双氧水转移1mol电子,故0.02mol双氧水转移0.02NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
16.禁止运动员使用兴奋剂是2012绿色奥运的重要举措之一,下图是兴奋剂利尿酸的结构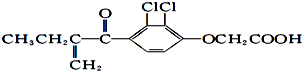 .关于它的说法正确的是( )
.关于它的说法正确的是( )
 .关于它的说法正确的是( )
.关于它的说法正确的是( )| A. | 利尿酸的化学式为:C13H14O4Cl2 | |
| B. | 利尿酸最多可与4 molH2发生反应 | |
| C. | 利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 利尿酸在一定条件下能发生消去反应 |
17.根据热化学方程式:S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1,下列分析正确的是( )
| A. | 1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量 |
14.海水中蕴藏着丰富的资源,在实验室中去少量海水,进行如下流程的实验:

粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,提纯的步骤有:①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.
其正确的操作顺序是( )(填写序号字母).

粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,提纯的步骤有:①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.
其正确的操作顺序是( )(填写序号字母).
| A. | ⑤②③①⑥④⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤②①③④⑥⑦ | D. | ⑤③②①⑥④⑦ |
1.下列说法不正确的是( )
| A. | 氢氧化铁胶体可用于净水 | |
| B. | 镁合金可用于制造导弹、飞机的部件 | |
| C. | 石灰石-石膏法可用于燃煤的脱硫 | |
| D. | 焦炭在炼铁高炉中用于直接还原铁矿石 |
11.用NA表示阿伏加德罗常效的数值,下列说法正确的是( )
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
15.100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,用的方法是( )
| A. | 加入适量6mol•L-1的盐酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加入少量铜粉 | D. | 加入少量金属钠 |
1.已知298 K,101kPa时,2SO2(g)+O2(g)???2SO3(g)△H=-197kJ•mol-1.在相同温度和压强下,向密闭容器中通入2mol SO2和1mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1mol SO2,0.5mol O2 和1mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A. | Q2<Q1<197 kJ•mol-1 | B. | Q2=Q1=197 kJ•mol-1 | ||
| C. | Q1<Q2<197 kJ•mol-1 | D. | Q2=Q1<197 kJ•mol-1 |
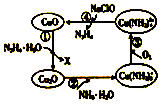 水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.
水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.