��Ŀ����
ʵ������ͨ����MnO2��Ũ���ᷴӦ��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ��
MnO2+4HCl��Ũ��  MnCl2+Cl2��+ 2H2O
MnCl2+Cl2��+ 2H2O
��1���ڸ÷�Ӧ�У�����1 mol Cl2���ɣ���������HCl�����ʵ����� mol��ת�Ƶ��ӵ����ʵ����� mol��
��2��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�����ClO-��ClO3-���ʵ���֮��Ϊ1��1�Ļ��Һ����Ӧ�Ļ�ѧ����ʽ�� ��
��3����ֽ�����˶�����������ϴʱ������ʹ�á�����顱����Ҫ�ɷ������ᣩ�롰84����Һ������Ҫ�ɷ���NaClO�����������ж����¼����Ը�����Ļ�ѧ֪ʶ������ԭ���ǣ������ӷ���ʽ��ʾ�� ��
��1��2 2 ��2��4Cl2+8NaOH = 6NaCl+NaClO3+NaClO+4H2O
��3��Cl-+ClO-+2H+ = Cl2��+H2O
���������������1����1mol Cl2�μӷ�Ӧʱ����Cl2��2HCl��֪��������HClΪ1mol��2=2mol��ת�Ƶ��ӵ����ʵ���Ϊ��1mol����4-2��=2mol����2���������֪��Ӧ��Ϊ�������������ƣ�������ΪNaCl��NaClO3��NaClO��H2O����Ԫ�ش�0�۱�ΪNaClO3��+5�ۣ�������ԭ��ʧ10�����ӣ���Ԫ�ش�0�۱�ΪNaCl��-1�ۣ�������ԭ�ӵõ�2�����ӣ������Ȼ���ǰ��ϵ��Ϊ6��������ǰ��ϵ��Ϊ1���ٸ���ԭ���غ�Ϳɵõ���Ӧ�Ļ�ѧ����ʽΪ��4Cl2+8NaOH = 6NaCl+NaClO3+NaClO+4H2O����3������������ǿ�����ԣ�������ǿ��ԭ�ԣ�������������������ԭ��Ӧ�����������ʻ�ѧ��Ӧ����ʽΪ��Cl-+ClO-+2H+ = Cl2��+H2O��
���㣺MnO2��Ũ���ᷴӦ��ȡ����

��1��ij��ѧ����С���ú���Ϊԭ����ȡ������ˮ�����������Ȼ�̼�ڵ�ˮ����ȡ�ⵥ�ʣ����÷�Һ©������������Һ����ʵ������ɷֽ�Ϊ���¼�����
| A����ʢ����Һ�ķ�Һ©����������̨����Ȧ�У� |
| B����50mL��ˮ��15mL���Ȼ�̼�����Һ©���У����Ǻò������� |
| C�������Һ©���������Ͽڲ������Ƿ�©Һ�� |
| D����ת©��������������ʱ�����������������رջ����� |
F���ӷ�Һ©���Ͽڵ����ϲ�ˮ��Һ��
G����©���ϿڵIJ�������ʹ���ϵİ��ۣ���С�ף���©�����ϵ�С�ף�
H�����á��ֲ㡣�ʹ�ʵ�飬���������գ�
��ȷ���������˳���ǣ� ��
��2����MnSO4������Ļ����Һ�����K2S2O8����������أ�����Һ�ᷢ���·�Ӧ��Mn2++S2O82?+H2O��MnO4?+SO42?+H+
�÷�Ӧ�����ڼ���Mn2+�Ĵ��ڡ������������� ��
���÷�Ӧ���õ������̸�Ϊ�Ȼ��̣������������Ĺ�����ط�Ӧʱ�����и�����ء�����ء����������⣬�����������ﻹ�� ��
��3����NaBiO3���壨��ɫ�ܣ����뵽MnSO4��H2SO4�Ļ����Һ����ȣ������ܽ��Ϊ������Һ���������·�Ӧ�� NaBiO3+ MnSO4+ H2SO4�� Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
����ƽ������Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ��
��������Ӧ�л�ԭ������
 ��
�� Cr2O72-����ɫ����H2O��
Cr2O72-����ɫ����H2O�� Cr3����aq����3OH����aq���������£�Cr��OH��3���ܶȻ�Ksp��10��32����c��Cr3��������10��5 mol��L��1ʱ����Ϊc��Cr3�����Ѿ���ȫ�������ֽ��ڢ۲���Һ��pH����4����ͨ������˵��Cr3���Ƿ������ȫ����д��������̣���____________________________________________________________________________��
Cr3����aq����3OH����aq���������£�Cr��OH��3���ܶȻ�Ksp��10��32����c��Cr3��������10��5 mol��L��1ʱ����Ϊc��Cr3�����Ѿ���ȫ�������ֽ��ڢ۲���Һ��pH����4����ͨ������˵��Cr3���Ƿ������ȫ����д��������̣���____________________________________________________________________________��

 2NO2 (g) ���� һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1 mol N2O4 ����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��
2NO2 (g) ���� һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1 mol N2O4 ����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��
 CO(NH2)2 (l) + H2O (l)��
CO(NH2)2 (l) + H2O (l)��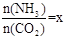 ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����___________��
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����___________��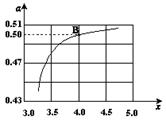
 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O ��I
��I