题目内容
【题目】如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置。
Ⅰ.浓硝酸的强氧化性实验
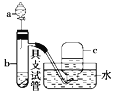
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:___________________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象_________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是____________________(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是________________________________________________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:______________________________________。
【答案】 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 铜片溶解,试管中溶液变蓝,且有红棕色气体产生 往分液漏斗中加入水稀释浓硝酸,打开活塞,放入稀硝酸 C 利用Cu与浓硝酸反应生成的NO2排出具支试管中的空气,有利于观察Cu与稀硝酸的反应产物 ② 铜片的质量相同,溶液体积相同,生成Cu2+的浓度相同;加热绿色溶液,有红棕色气体产生,溶液变成蓝色
【解析】(1)铜与浓硝酸发生氧化还原反应生成硝酸铜和二氧化氮和水,化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(2)实验中铜片溶解,试管中溶液变蓝,且有红棕色气体产生,则可说明浓硝酸具有强氧化性,氧化铜单质生成铜离子;(3)上述反应完成后,向试管中加水将浓硝酸稀释成稀硝酸,如果能继续溶解铜,则可进一步证明稀硝酸也具有强氧化性;(4)若b生成的气体为红棕色,说明气体为二氧化氮,若b生成的气体为无色,接触空气后变为红棕色,说明生成气体为一氧化氮,答案选C;(5)由于NO易被氧气氧化为NO2,所以好处是利用Cu与浓硝酸反应生成的NO2排出具支试管中的空气,有利于观察Cu与稀硝酸的反应产物;(6)等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,提出这可能是Cu2+浓度差异引起的,是错误的,是因生成Cu2+的浓度相同,溶液呈“绿色”是Cu2+与NO2混合的结果可由加热绿色溶液,有红棕色气体产生,溶液变成蓝色来说明。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案