题目内容
下列物质属于非电解质且溶于水能导电的是( )
| A、Na |
| B、H2S |
| C、Cl2 |
| D、NH3 |
考点:电解质与非电解质,电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:电解质是在水溶液中或熔融状态下能导电的化合物;非电解质是在水溶液中和熔融状态下都不能导电的化合物;电解质导电的要求必须是化合物且自身电离出的离子导电;酸、碱、盐都是电解质;
解答:
解:A.Na是单质,既不是电解质也不是非电解质,故A错误;
B.H2S在水溶液里能电离出阴阳离子而使溶液导电,所以HCl是电解质,故B错误;
C.Cl2溶于水能导电,但Cl2是单质,既不是电解质也不是非电解质,故C错误;
D.NH3的水溶液能导电,是因NH3和水反应生成一水合氨,一水合氨电离生成离子而导电,即发生电离不是NH3本身,故NH3属于非电解质,故D正确;
故选D;
B.H2S在水溶液里能电离出阴阳离子而使溶液导电,所以HCl是电解质,故B错误;
C.Cl2溶于水能导电,但Cl2是单质,既不是电解质也不是非电解质,故C错误;
D.NH3的水溶液能导电,是因NH3和水反应生成一水合氨,一水合氨电离生成离子而导电,即发生电离不是NH3本身,故NH3属于非电解质,故D正确;
故选D;
点评:本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化学用语表示正确的是( )
A、四氯化碳分子比例模型: | ||
B、COS的电子式是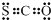 | ||
| C、次氯酸的结构式为 H-Cl-O | ||
D、
 |
1mol MnO2与含4mol HCl的浓盐酸共热,在不考虑HCl挥发的情况下得到氯气为( )
| A、2mol |
| B、1mol |
| C、小于1mol |
| D、大于2mol |
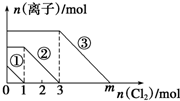 向仅含Fe2+、I-、Br-的溶液中(忽略由水电离出的H+和OH-)通入一定量的氯气,溶液中这三种离子物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br-的溶液中(忽略由水电离出的H+和OH-)通入一定量的氯气,溶液中这三种离子物质的量的变化如图所示.下列说法中正确的是( )| A、③代表I-的变化情况 |
| B、①代表Fe2+的变化情况 |
| C、m的数值等于9 |
| D、原混合溶液中n(FeBr2)=3 mol |
有一瓶Na2SO3溶液,可能已部分氧化,某学生进行如下实验:取少量溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入过量稀硝酸溶液,充分振荡后仍有白色沉淀,结论正确的是( )
| A、Na2SO3溶液已部分氧化 |
| B、加入Ba(NO3)2溶液后生成的沉淀中一定含有BaSO4 |
| C、加硝酸后的不溶沉淀一定是BaSO4 |
| D、此实验能确定Na2SO3溶液是否部分氧化 |
化学实验室,金属钠着火时,可选择的灭火材料是( )
| A、干冰(CO2固体)灭火器 |
| B、沙子 |
| C、泡沫灭火器 |
| D、水 |
关于浓度均为0.1mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )
| A、c(NH4+):③>① |
| B、水电离出的c(H+):①>② |
| C、①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O) |
| D、①和③等体积混合后的溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
以下化学反应的离子方程式书写正确的是( )
| A、铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ |
| B、氯气与溴化钠溶液反应:Cl2+2Br-═Br2+2Cl- |
| C、硫酸与氢氧化钡溶液反应:H++OH-═H20 |
| D、碳酸钙与盐酸反应:CO32-+2H+═H2O+C02↑ |