题目内容
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
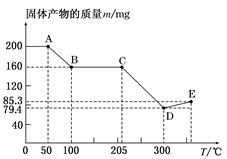
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
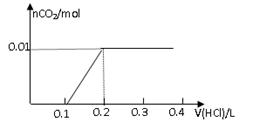
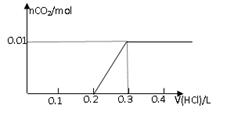
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
(1)5.6 L (1分)
(2)Na2CO3 0.1 mol ; NaOH 0.3 mol(4分)
(3)①V(CO2)=0.224m1 L 2分) ② ≤ c(NaOH) ≤
≤ c(NaOH) ≤  (每种情况各1分,共3分)
(每种情况各1分,共3分)
(4)取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。(2分)
c(NaOH)=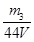 mol/L(2分)
mol/L(2分)
或者:取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。(2分)
c(NaOH)=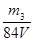 mol/L(2分) (其它合理答案也给分)
mol/L(2分) (其它合理答案也给分)
解析试题分析:(1)250 mL 1 mol/L的NaOH溶液中氢氧化钠的物质的量为0.25mol,则根据方程式NaOH+CO2=NaHCO3可知,最多可吸收CO2的物质的量为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,这说明参加反应的CO2的质量是4.4g,物质的量为0.1mol。氢氧化钠的物质的量为0.5mol,因此根据反应式2NaOH+CO2=Na2CO3+H2O可知氢氧化钠是过量的,所以所得固体为氢氧化钠和碳酸钠的混合物,其中碳酸钠0.1mol,氢氧化钠是0.5mol-0.1mol×2=0.3mol。
(3)①生成物不论是碳酸钠还是碳酸氢钠均能与氢氧化钙反应生成碳酸钙白色沉淀,则根据碳元素守恒可知CO2的物质的量是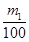 mol,在标准状况下的体积为
mol,在标准状况下的体积为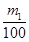 mol×22.4L/mol=0.224m1 L。
mol×22.4L/mol=0.224m1 L。
②如果生成物只有NaHCO3时,则根据原子守恒可知c(NaOH)=  ;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)=
;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)=  ;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以:
;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以: ≤ c(NaOH) ≤
≤ c(NaOH) ≤  。
。
(4)要测定氢氧化钠溶液的浓度,则可以将其转化为碳酸氢钠,然后通过称量其质量得出氢氧化钠的质量,进而得出其浓度,或者计算参加反应的二氧化碳质量,进而得出氢氧化钠的物质的量,所以正确的实验步骤可以为:取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。由于增加的质量即为参加反应的CO2质量,所以根据原子守恒可知碳酸氢钠的物质的量为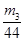 ,则氢氧化钠的物质的量也是
,则氢氧化钠的物质的量也是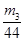 ,所以其浓度为
,所以其浓度为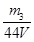 。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为
。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为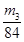 ,则根据原子守恒可知氢氧化钠的物质的量也是
,则根据原子守恒可知氢氧化钠的物质的量也是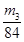 ,所以其浓度为
,所以其浓度为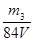 。
。
考点:考查氢氧化钠与二氧化碳反应的有关判断与计算

(8分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答有关问题。
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要KCl的质量为________g(保留小数点后一位) |
| ②称量KCl固体 | 称量需要用到的主要仪器是________________ |
| ③将KCl加入100 mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施? ________________ |
| ④将烧杯中溶液转移至500 mL容量瓶中 | 为了防止溶液溅出,应采取什么措施? __________________ |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至离刻度线1 cm~2 cm处应如何操作?____________________ |
(2)在进行④步操作时未将洗涤烧杯、玻璃棒的洗涤液转移至容量瓶,则配制溶液浓度
________(填“偏高”、“偏低”或“不影响”)。
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需________。