题目内容
7.下列有关硫酸和硝酸的说法中正确的是( )| A. | 将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 | |
| B. | 向50mL12mol•L-1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 | |
| C. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | |
| D. | 运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
分析 浓硫酸具有强氧化性,可与金属锌、铜等反应生成二氧化硫气体,但稀硫酸与铜不反应,稀硫酸与活泼金属反应生成氢气,以此解答.
解答 解:A.浓硫酸和锌反应生成SO2,随着反应的进行,硫酸浓度逐渐降低,稀硫酸与锌反应生成氢气,故A错误;
B.由于Cu足量,则浓硝酸完全反应,被还原的硝酸生成NO2、NO,由N元素守恒可知:2n[Cu(NO3)2]+n(气体)=n(HNO3)=0.05L×12mol/L=0.6mol,生成气体只有NO2时,被还原的硝酸达极大值,根据电子转移守恒2n[Cu(NO3)2]=n(NO2),联立方程解得:n(NO2)=0.3mol,而随反应的进行浓硫酸要变稀硫酸,所以生成NO2小于0.3mol,故B错误;
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,酸性条件下,NO3-与Fe2+发生氧化还原反应生成NO,NO在试管口被氧化生成红棕色的二氧化氮气体,故C正确;
D.运输保存浓硫酸的槽罐车一旦泄露后,如果用水冲洗,硫酸被稀释而生成氢气,易爆炸,故D错误;
故选C.
点评 本题考查浓硫酸的性质,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握浓硫酸、稀硫酸的性质的异同,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列实验装置图能达到实验目的是( )
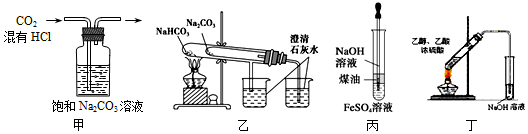

| A. | 图甲可除去CO2种混有的HCl气体 | |
| B. | 图乙可用于比较Na2CO3和NaHCO3的热稳定性 | |
| C. | 图丙可制得Fe(OH)2沉淀且一定时间内不变质 | |
| D. | 图丁可制得并分离出乙酸乙酯 |
15.分子式为C5H12O,分子中含有3个甲基,且能与金属钠反应的有机物共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.下列选用的仪器和药品能达到实验目的是( )
| A. |  可用于吸收NH3或HCl,并防止倒吸 | |
| B. | 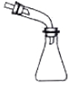 蒸馏时的接收装置 | |
| C. |  除去SO2中的少量HCl | |
| D. |  准确量取一定体积K2Cr2O7标准溶液 |
12.抗肿瘤用化学品氨基酮戊酸(H2NCH2COCH2CH2COOH),下列有关说法错误的是( )
| A. | 含有5种官能团 | |
| B. | 具有酸性、碱性 | |
| C. | 可以发生取代、加成、还原、氧化反应 | |
| D. | 能溶于水 |
19. 常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
 常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )| A. | 乙醇发生还原反应 | |
| B. | b极上的电极反应式为O2+4e-+H2O--4OH- | |
| C. | 电池工作时,电解液中的H+由a极向b极迁移 | |
| D. | 当外电路中有1.2 mol电子转移时,能产生4.48 L CO2 |
16.盐MN溶于水存在如图过程,下列有关说法中不正确的是( )
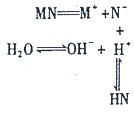
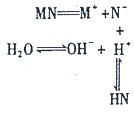
| A. | 该过程可表示MN的水解过程 | B. | 相同条件下结合H+的能力N->OH- | ||
| C. | 该过程使溶液中的c(OH-)>c(H+)] | D. | 溶液中存在c(HN)=c(OH-)-c(H+) |
15.下列变化属于吸热反应的是( )
| A. | 锌粒投入稀硫酸中产生氢气 | B. | 生石灰溶于水 | ||
| C. | 酸碱中和 | D. | Ba(OH)2•8H2O与NH4Cl晶体混合 |

 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl .
. .
. .
. .
.