题目内容
已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
 2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是 | A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ此时有2 mol SO2(g)被氧化 |
D
试题分析:2SO2(g)+O2(g)
 2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),该反应为放热反应,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,故A错误;该反应为可逆反应,所以将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量小于Q kJ,故B错误;该反应为放热反应,所以该平衡向逆反应方向移动,但是增大压强,反应向正方向移动,故C错误;将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化,故D正确。
2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),该反应为放热反应,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,故A错误;该反应为可逆反应,所以将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量小于Q kJ,故B错误;该反应为放热反应,所以该平衡向逆反应方向移动,但是增大压强,反应向正方向移动,故C错误;将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化,故D正确。点评:本题考查了可逆反应、化学反应中能量的变化,属于对基础知识的考查,该题要理解好可逆反应是不能百分之百进行的。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目

 C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。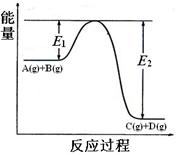


 2Z(正反应为放热反应),若升高温度则能使( )
2Z(正反应为放热反应),若升高温度则能使( )