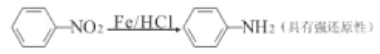
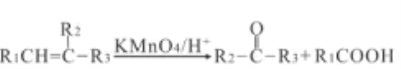题目内容
【题目】用CH4催化还原NOx可以消除氮氧化物的污染。
已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A. 173.4 kJ B. 232 kJ C. 368.8 kJ D. 114.8 kJ
【答案】A
【解析】
(1)CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,(2)CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1由盖斯定律计算[(1)+ (2)]/2得到CH4(g)+2NO2(g)=== N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
在标准状况下4.48 L CH4还原NO2至N2,放出的热量![]() ,故选A。
,故选A。

练习册系列答案
相关题目