题目内容
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。流程如下图所示:
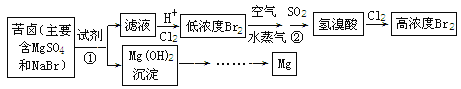
(1)用电子式表示Br2的形成过程________。提取Br2 时,第一次通入Cl2 后发生反应的离子方程式是_______;ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______(填“增大”或“减小”),得电子能力逐渐减弱。②中SO2表现 _________(填“氧化”“还原”“酸”“碱”)性;
(2)镁在元素周期表中的位置是________;为了实现对镁离子的富集,①中分离提纯的实验操作名称是__________;
(3)用MgCl2溶液制成无水MgCl2,加热溶液过程中,会生成Mg(OH)Cl溶液和一种酸性气体。写出该反应的化学方程式______。
【答案】![]() Cl2+2Br-==Br2+2Cl- 增大 还原性。 第三周期ⅡA族 过滤 MgCl2+H2O====Mg(OH)Cl+HCl
Cl2+2Br-==Br2+2Cl- 增大 还原性。 第三周期ⅡA族 过滤 MgCl2+H2O====Mg(OH)Cl+HCl
【解析】
(1)此小题考查了电子式的书写,元素周期律,物质的性质。Br是第四周期,第ⅦA族元素,最外层有7个电子,达到8电子稳定结构需得一个电子,则两个Br原子可形成一对共用电子对,通过共价键结合形成Br2;同主族元素从上到下原子半径逐渐增大,失电子能力增强,得电子能力减弱,元素的非金属性逐渐减弱;SO2与溴水发生氧化还原反应表现出还原性;
(2)考查原子结构与元素在周期表中位置的关系;物分离提纯的方法;
(3)考查根据已知条件书写方程式;
(1)Br是第四周期,第ⅦA族元素,最外层有7个电子,达到8电子稳定结构需得一个电子,则两个Br原子可形成一对共用电子对,通过共价键结合形成Br2的,形成过程为![]() ;提取Br2 时,第一次通入Cl2 后发生的反应是氯气氧化溴离子为溴单质,离子方程式为Cl2+2Br-==Br2+2Cl- ;ⅦA族元素,同主族元素从上到下原子半径逐渐增大,失电子能力增强,得电子能力减弱,元素的非金属性逐渐减弱;②中SO2中的S元素的化合价升高,失电子表现出还原性。本小题答案为:
;提取Br2 时,第一次通入Cl2 后发生的反应是氯气氧化溴离子为溴单质,离子方程式为Cl2+2Br-==Br2+2Cl- ;ⅦA族元素,同主族元素从上到下原子半径逐渐增大,失电子能力增强,得电子能力减弱,元素的非金属性逐渐减弱;②中SO2中的S元素的化合价升高,失电子表现出还原性。本小题答案为:![]() ;Cl2+2Br-==Br2+2Cl-;增大;还原性。
;Cl2+2Br-==Br2+2Cl-;增大;还原性。
(2)镁为12号元素,核外有12个电子,为2、8、2排布,核外有3层,最外层有2个电子,在元素周期表中的位置是第三周期ⅡA族;为了实现对镁离子的富集,①步中加入的试剂为碱性物质使镁离子生成氢氧化镁沉淀,则分离提纯的实验操作为过滤。本小题答案为:第三周期ⅡA族;过滤。
(3)用MgCl2溶液制成无水MgCl2,加热溶液过程中,会生成Mg(OH)Cl溶液和一种酸性气体,此酸性气体为HCl气体,方程式为MgCl2+H2O====Mg(OH)Cl+HCl。本小题题答案为:MgCl2+H2O====Mg(OH)Cl+HCl。

【题目】下列实验装置(加热装置已略去)或操作合理的是( )
|
|
|
|
A.吸收氨气并防倒吸 | B.用SO2与Ba(NO3)2反应获得BaSO3沉淀 | C.分离溴苯和苯的混合物 | D. 验证HCl的溶解性 |
A. A B. B C. C D. D