题目内容
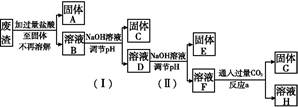
为了检验市场上常见两种金属饮料瓶的主要成分,某小组取甲、乙两种饮料瓶,将其剪碎作为样品,分别按下述步骤进行实验:
I.取少量样品于试管中,加入盐酸,充分反应后过滤。
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液。
步骤II的实验现象如下:
(1)样品甲中金属的主要成分是 ,生成白色沉淀反应的离子方程式是 。
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是 ,白色沉淀变为红褐色反应的化学方程式是 。
I.取少量样品于试管中,加入盐酸,充分反应后过滤。
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液。
步骤II的实验现象如下:
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
(1)样品甲中金属的主要成分是 ,生成白色沉淀反应的离子方程式是 。
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是 ,白色沉淀变为红褐色反应的化学方程式是 。
(1)Al Al3++3OH—="=" Al(OH)3↓ (2)Fe2+ 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3
试题分析:样品甲:2Al+6HCl=2AlCl3+3H2↑. AlCl3+3NaOH= Al(OH)3↓+3NaCl. Al(OH)3+OH-=AlO2-+ H2O;
样品乙: Fe+2HCl=FeCl2+H2↑. FeCl2+2NaOH= Fe(OH)2↓+3NaCl, 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3
故样品甲中金属的主要成分是是铝,生成白色沉淀反应的离子方程式是Al3++3OH—="=" Al(OH)3↓(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是Fe2+白色沉淀变为红褐色反应的化学方程式是: 4Fe(OH)2 + O2+2H2O == 4Fe(OH)3。

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目