题目内容
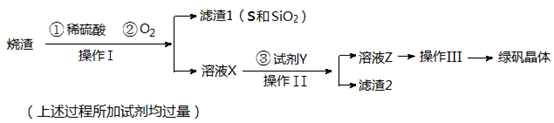
孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: 
试回答下列问题:
(1)B物质的化学式是 在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
(3)由溶液C获得CuSO4·5H2O,需要经过 ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是 。
(4)制备CaCO3时,先通入 (填NH3或CO2),若实验过程中有氨气逸出,可选用下列装置中的 (填代号)装置吸收氨气。(烧杯中的液体都为水)

(1)SiO2 (1分) , D(1分)
(2)氧化(1分) ,H2O2 + 2Fe2+ +2H+ = 2Fe3+ + 2H2O(2分) ,不引人新的杂质离子Cl-(2分)(3)蒸发浓缩,冷却结晶(1分);玻璃棒(1分)
(4)NH3(1分) BC(2分)
解析试题分析:(1)SiO2不溶于硫酸;Fe3+遇 KSCN溶液变成血红色,是Fe3+的特性,不会受到其他离子的干扰。(2)加入双氧水使二价铁离子转变为三价铁离子,最后以氢氧化铁形式析出;除去杂质的原则是不引入新的杂质。(3)溶液析出固体的实验操作。(4)制备CaCO3时会吸收气体,为防止倒吸,选用BC装置。
考点:物质的相互转换和制备,化学式的书写

.(16分)化学实验是科学探究的基础。请回答有关实验问题:
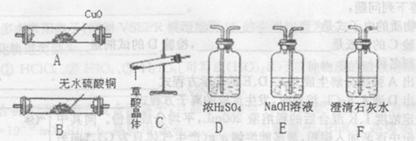
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
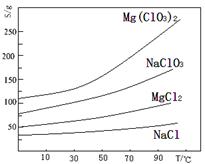
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
①由下表可以看出:保存液态ClO2的条件是密封、 ;ClO2与碱反应的离子方程式 ;观察下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是 ;应控制析出晶体的温度范围是 。
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图B所示装置模拟工业制法制取并收集液态ClO2,请模仿下图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注。

PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量) 2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
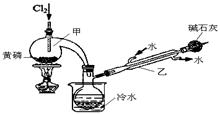
(1)向甲中通入干燥的Cl2之前,需先通入一段时间CO2,目的是 。
(2)实验过程中,应控制 ,以减少PCl5的生成。
(3)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(4)已知:a.H3PO3+H2O+I2
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI①测定产品中PCl3质量分数的实验如下,请补充相应的实验步骤:
步骤1:迅速移取m g产品,水解完全后在500mL容量瓶中定容。
步骤2:从容量瓶中移取25.00mL溶液置于锥形瓶中。
步骤3:准确加入c1 mol/L碘溶液V1 mL(过量),再 。
步骤4:用标准Na2S2O3溶液回滴过量的碘,将近终点时加入3 mL淀粉溶液,继续滴至终点(蓝色溶液褪色);滴至终点时消耗c2 mol/L Na2S2O3溶液V2 mL。
②根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示)。
为测定硫酸亚铁铵晶体【(NH4)2Fe (SO4)2 · xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+。
再重复步骤二两次。
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、 、转移、洗涤并转移、 、摇匀。
(2)用 滴定管盛放KMnO4溶液。
(3)当滴入最后一滴KMnO4溶液,出现 ,即到达滴定终点。反应的离子方程式:
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
实验测得该晶体中铁的质量分数为 。(保留两位小数)
(5)根据步骤二填空:
①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将 。(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定后俯视读数,测得样品中铁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
为提纯下列物质(括号内为少量杂质),所选除杂试剂与主要分离方法都正确的是
| | 不纯物质 | 除杂试剂 | 分离方法 |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |