题目内容
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是
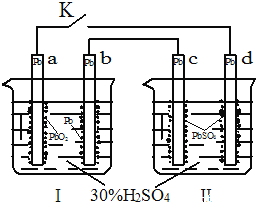
A. K闭合时,d电极反应式:PbSO4+2H2O-2e-═PbO2+4H++SO42-
B. 当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2mol
C. K闭合时,II中SO42-向c电极迁移
D. K闭合一段时间后,II可单独作为原电池,d电极为正极
【答案】C
【解析】A.K闭合时Ⅰ为原电池,Ⅱ为电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4+2H2O﹣2e﹣=PbO2+4H++SO42﹣,故A正确;
B.在上述总反应式中,得失电子总数为2e﹣,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,故B正确;
C.K闭合时d是阳极,阴离子向阳极移动,故C错误;
D.K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,故D正确.故选C.

【题目】下列空气污染物与其主要来源对应错误的是
污染物 | 来源 | |
A | SO2 | 雷电时在空气中产生 |
B | NO和NO2 | 飞机、汽车尾气 |
C | 悬浮颗粒物 | 建筑施工、燃煤的使用 |
D | HCHO | 家具生产与使用、质量低劣的涂料的使用 |
A.AB.BC.CD.D
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c (NO2) | c (NO) | c (O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B. 达平衡时,容器Ⅱ中c(O2)/ c(NO2)比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为T2时,若k正=k逆,则T2>T1

