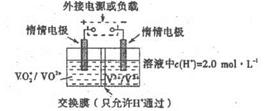
题目内容
某城市用水中含c(Ca2+)为1.0×10-3 mol·L-1,c(Mg2+)为5.0×10-4 mol·L-1,c(HCO3-)为8.0×10-4 mol·L-1。如用药剂软化该水1 000 L,应加入Ca(OH)2________g,Na2CO3________g;如果水中含Mg2+,加入Na2CO3后,为尽量减少水中的Mg2+的浓度,可将水加热至沸,加热时反应的化学方程式为________。
66.6 116.6 MgCO3+2H2O Mg(OH)2↓+CO2↑+H2O
Mg(OH)2↓+CO2↑+H2O
 Mg(OH)2↓+CO2↑+H2O
Mg(OH)2↓+CO2↑+H2O首先要搞清沉淀的关系:
Ca2+→Na2CO3 沉淀为CaCO3
Mg2+→Ca(OH)2 沉淀为Mg(OH)2
HCO3-→Ca(OH)2 沉淀为CaCO3
Ca(OH)2的用途有两个,一是沉淀Mg2+,二是与HCO3-反应生成CO32-,故所消耗Ca(OH)2的质量便可求出:
m[Ca(OH)2]= mol×74 g·mol-1=66.6 g
mol×74 g·mol-1=66.6 g
加入Na2CO3的用途自然是沉淀Ca2+,溶液中原有Ca2+为1 mol,又加入了Ca(OH)2的量为0.9 mol,从而使得Ca2+总物质的量为1.9 mol;又因为0.8 mol HCO3-已转化为0.8 mol CO32-,故加入Na2CO3的量应为:
m(Na2CO3)=(1.9-0.8)mol×106 g·mol-1=116.6 g。
Ca2+→Na2CO3 沉淀为CaCO3
Mg2+→Ca(OH)2 沉淀为Mg(OH)2
HCO3-→Ca(OH)2 沉淀为CaCO3
Ca(OH)2的用途有两个,一是沉淀Mg2+,二是与HCO3-反应生成CO32-,故所消耗Ca(OH)2的质量便可求出:
m[Ca(OH)2]=
 mol×74 g·mol-1=66.6 g
mol×74 g·mol-1=66.6 g加入Na2CO3的用途自然是沉淀Ca2+,溶液中原有Ca2+为1 mol,又加入了Ca(OH)2的量为0.9 mol,从而使得Ca2+总物质的量为1.9 mol;又因为0.8 mol HCO3-已转化为0.8 mol CO32-,故加入Na2CO3的量应为:
m(Na2CO3)=(1.9-0.8)mol×106 g·mol-1=116.6 g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
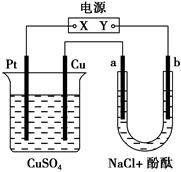
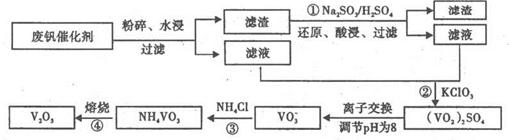

 VO2++V3++H2O
VO2++V3++H2O