题目内容
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol电子,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。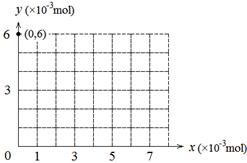
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol电子,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。

(1)0.006 酸性 (2)② 不能 该反应只能说明I2的还原性比Br2强
(3)BrO3-> IO3-> Br2 > I2 BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O
(4)
(3)BrO3-> IO3-> Br2 > I2 BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O
(4)

试题分析:(1)I-被氧化成I2,0.006mol I-被氧化时转移电子数为0.006mol。硫酸表现出的是酸性作用。
(2)ii是KBrO3氧化I2,所以②反应符合。该反应只能说明I2的还原性比Br2强,不能说明碘的非金属性强于溴。
(3)根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性BrO3-> IO3-> Br2 > I2。KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O。
(4)整个过程发生如下两个反应:①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ②2BrO3-+ I2 = 2IO3-+ Br2,当
KBrO3加入1×10-3mol时I-全部被氧化成I2,当KBrO3加入7×10-3mol时I2全部被氧化成IO3-。所以图像为
 。
。点评:本题主要根据实验的现象来确定反应。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Fe+Al2O3
2Fe+Al2O3 2MgO+C
2MgO+C 2NH3
2NH3 Fe+TiO2+H2O,下列有关该反应的说法错误的是( )
Fe+TiO2+H2O,下列有关该反应的说法错误的是( ) 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2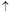 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。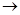 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。