��Ŀ����
ʵ���ҳ���MnO2��Ũ���ᷴӦ�Ʊ�Cl2������װ����ͼ��ʾ����
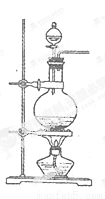
(1)�Ʊ�ʵ�鿪ʼʱ���ȼ��װ�������ԣ��������IJ��������ǣߣ�����ţ�
A.����ƿ�м���MnO2��ĩ
B.����
C.����ƿ�м���Ũ����
(2)�Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ�������ʵ�鷽����
������������AgNO3��Һ��Ӧ���������ɵ�AgCl������
�ҷ�������������к͵ζ����ⶨ��
������������֪��CaCO3����������Ӧ������ʣ���CaCO3������
��������������Zn ��Ӧ���������ɵ�H2�����
�̶����������жϺ�ʵ�飺
�� ����������������� ��
�� �����ҷ���ʵ�飺ȷ��ȡ������Һϡ��һ����������Ϊ������
a.��ȡ����20.00 mL����0 . 1000 mol��L-1NaOH����Һ�ζ�������22.00mL���ôεζ��������������Ũ��Ϊ mol��L-1
b.ƽ�еζ�����ʵ������
�� �жϱ�������ʵ���� ���ƫ����ƫС����ȷ������
����֪��Ksp��CaCO3) = 2.8��10-9��Ksp��MnCO3) = 2.3��10-11
�� ���ж�����ʵ�飺װ����ͼ��ʾ���г���������ȥ����

(i) ʹY�ι��еIJ�����Һ��п����Ӧ����ȷ�����ǽ� ת�Ƶ� �С�
(ii)��Ӧ��ϣ�ÿ���1 ���Ӷ�ȡ������������������μ�С��ֱ�����䡣���������μ�С��ԭ���ǣߣ��ų�������ʵ�������Ӱ�����أ���
 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�ij��ҵ��ˮ�н����±������е�5�֣�������ˮ�ĵ��뼰���ӵ�ˮ�⣩���Ҹ������ӵ����ʵ���Ũ����ȣ���Ϊ0.1 mol��L��1��
������ | K+ Mg2+ Fe3+ Al3+ Fe2+ |
������ | Cl�� CO32�� NO3�� SO42�� SiO32�� |
��ͬѧ��̽����ˮ����ɣ�����������ʵ�飺
�� �ò�˿պȡ������Һ���ڻ��������գ�����ɫ���棨����ɫ�ܲ����۲죩��
�� ȡ������Һ������KSCN��Һ�����Ա仯��
�� ��ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����ʱ��Һ��Ȼ���壬����Һ������������䡣
�� ��������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɡ�
���ƶϣ�
��1���ɢ١��ڡ����жϣ���Һ��һ�������е���������______��һ����������������_______��д���ӷ��ţ���
��2�����м�����������������ɫ����ĵ����ӷ���ʽ��_____________��
�������ɰ�ɫ���������ӷ���ʽ��_______________��
��3�����������ú���ɫ����ͨ��ˮ�У��������ɫ���������Ļ�ѧ��Ӧ����ʽΪ_________��
��4����ͬѧ����ȷ��ԭ��Һ��������������_________����������________����д���ӷ��ţ�
��25 ��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵���������(����)
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50��
B. ��Ӧ�ɱ�ʾΪX+3Y  2Z����ƽ�ⳣ��Ϊ1 600(mol/L) -2
2Z����ƽ�ⳣ��Ϊ1 600(mol/L) -2
C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��


 4NO(g)+CO2(g)+2H2O(l) ��H=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) ��H=-662kJ/mol
