题目内容
【题目】下表是元素周期表的一部分,请按要求回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素的原子结构示意图为: ;
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应的水化物反应的离子方程式: ;
(3)元素④与元素⑦形成的化合物中的化学键类型是 ,写出该化合物的电子式: ;
(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中酸性最弱的是 (填化学式);
(5)元素③与元素⑩两者核电荷数之差是 ;
(6)气态氢化物能与其最高价氧化物对应的水化物反应生成盐的元素是: (填序号);
(7)④⑤⑥⑦四种元素的简单离子的半径由大到小的顺序为: (填化学式).
【答案】(1)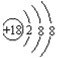 ;
;
(2)Al;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)离子键;![]() ;
;
(4)H2CO3;
(5)26;
(6)②;
(7)S2﹣>Cl﹣>Mg2+>Al3+
【解析】试题分析:由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br;
(1)稀有气体Ar最不活泼,原子核外有18个电子层,各层电子数为2、8、8,原子结构示意图为: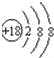 ;
;
(2)A元素的氢氧化物﹣﹣氢氧化铝是两性氢氧化物,⑨的最高价氧化物对应的水化物为KOH,Al与氢氧化钾反应生成偏铝酸钾与氢气,反应离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)元素④与元素⑦形成的化合物为MgCl2,由镁离子与氯离子构成,含有离子键,电子式为![]() ;
;
(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中高氯酸、硫酸、硝酸均为强酸,而碳酸为弱酸,故碳酸的酸性最弱;
(5)元素③与元素⑩两者核电荷数之差为第三、第四周期容纳元素种数,即原子序数形成8+18=26;
(6)氮元素的气态氢化物能与其最高价氧化物对应的水化物反应生成盐为硝酸铵,为表中②号元素;
(7)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越大离子半径越大,故离子半径:S2﹣>Cl﹣>Mg2+>Al3+。

