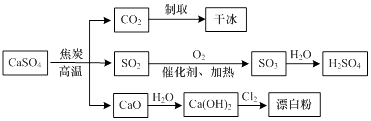
��Ŀ����
����Ŀ���±�ͼ1��Ԫ�����ڱ���һ���֣� 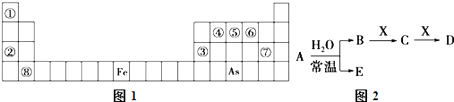
��֪A��B��C��D��E��X��Y���ɱ��и���Ԫ����ɵij������ʻ����������ͼ2��ʾ��ת����ϵ������������ͷ�Ӧ��������ȥ����
��1�����Ԫ�ط����� ��
��2������As����Ԫ���У��ǽ����Խ�ǿ��������Ԫ�ط��ţ���
��3����EΪ�������A��X�Ļ�ѧʽ�ֱ�Ϊ�� ��
��4��Y�ɢڢޢ�����Ԫ����ɣ�����ˮ��Һ��һ�������г�������������As����Y�ļ�����Һ��Ӧ��������1mol��ԭ��ʱ������2.5mol��������ת��5mol���ӣ��÷�Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1��Ca
��2��N
��3��NO2��Fe
��4��5ClO��+2As+6OH���T2AsO43��+5Cl��+3H2O
���������⣺����Ԫ�����ڱ�����ȷ����ΪH����ΪNa����ΪAl����ΪC����ΪN����ΪO����ΪCl����ΪCa����1������Ԫ�����ڱ���ȷ�����Ǹƣ�Ԫ�ط���ΪCa�����Դ��ǣ�Ca����2������N����As��ͬһ���壬����ͬ����Ԫ�����ϵ��·ǽ����Լ��������Էǽ����Խ�ǿ����N�����Դ��ǣ�N����3��A�ڳ�������ˮ��Ӧ�����������ȷ��A��NO2 �� E��NO����X��Fe�����Դ��ǣ�NO2��Fe����4��Y�ɢڢޢ�����Ԫ����ɣ�����ˮ��Һ��һ�������г���������������YΪNaClO��������1 mol��ԭ��ʱ������2.5 mol��������ת��5 mol���ӣ�˵����������AsԪ�صĻ��ϼ�Ϊ+5��ClԪ�صĻ��ϼ�Ϊ��1���÷�Ӧ���ӷ���ʽΪ��5ClO��+2As+6OH���T2AsO43��+5Cl��+3H2O�����Դ��ǣ�5ClO��+2As+6OH���T2AsO43��+5Cl��+3H2O��