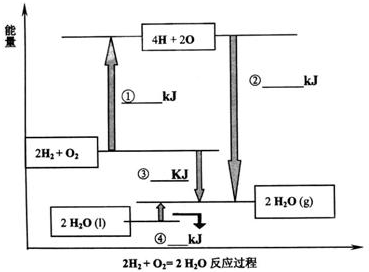
题目内容
下表是一些键能数据(KJ?mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)
(2)由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ?mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是
(3)通过上表预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,可以此来书写热化学方程式并计算反应热;
(3)RF、RCl、RBr、RI(R相同)的反应活性与卤代烃R-X键的键能大小有关.
故答案为:①不能;②不能;与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;218KJ?mol-1~330 KJ?mol-1;
(2)已知:热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ?mol-1,
可得出△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,则有化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,
由表中数据可得:2H2(g)+S2(g)→2H2S(g);△H=-229KJ?mol-1,
又知2H2(g)+S2(s)→2H2S(g);△H=-224.5KJ?mol-1,则S2(s)→S2(g);△H=+4.5kJ/mol,1mol S2(s)气化时将吸收4.5kJ的能量,
故答案为:化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;吸收;4.5;
(3)R相同时,卤素互化物的键能越大,越不易断裂,反应活性越小,所以RI>RBr>RCl>RF,
故答案为:RI>RBr>RCl>RF.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案(7分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol)
| | 键能 | | 键能 | | 键能 |
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 | Si—Si | 176 |
| Si—O | 460 | O=O | 497 | | |
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性 (填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________< C-Br键能 <__________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
(3)已知H2O(l)=H2O(g) ΔH=+44kJ/mol,请写出表示氢气燃烧热的热化学方程式:
(7分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol)
|
|
键能 |
|
键能 |
|
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
|
S=S |
255 |
H-S |
339 |
C-F |
427 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
C-O |
347 |
H-O |
464 |
Si—Si |
176 |
|
Si—O |
460 |
O=O |
497 |
|
|
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性 (填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________< C-Br键能 <__________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
(3)已知H2O(l)=H2O(g) ΔH=+44kJ/mol,请写出表示氢气燃烧热的热化学方程式: