题目内容
8.某次发射卫星火箭用N2H4(肼)作燃料,NO2作助燃剂,反应生成生成N2、液态H2O.资料显示:N2(g)+2O2(g)═2NO2(g),△H1=+67.2kJ/mol①
N2H4(g)+O2(g)═N2(g)+2H2O(l),△H2=-534kJ/mol②
则火箭燃烧1mol N2H4时所放出的热量为567.6KJ.
分析 依据热化学方程式和盖斯定律计算所需要的热化学方程式,然后根据热化学方程式进行计算.
解答 解:N2(g)+2O2(g)═2NO2(g)△H1=+67.2kJ/mol ①
N2H4(g)+O2(g)═N2(g)+2H2O(l)△H2=-534kJ/mol ②
由盖斯定律②-①×$\frac{1}{2}$得到:N2H4(g)+NO2(g)=$\frac{3}{2}$N2(g)+2H2O(l)△H=-567.6KJ/mol,所以火箭燃烧1molN2H4时所放出的热量为567.6KJ/mol×1mol=567.6KJ;
故答案为:567.6KJ.
点评 本题考查了化学反应中的热量计算,涉及盖斯定律的计算应用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.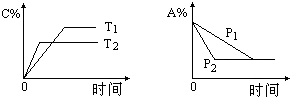 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
13.H2O在通电条件下会发生分解生成H2和O2.现有水1H218O在通电条件下发生分解,生成氢气和氧气的质量比为( )
| A. | 1:9 | B. | 1:36 | C. | 1:8 | D. | 8:9 |
17.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2amolZ,下列说法正确的是( )
| A. | 其他条件不变,向平衡后的体系中加入1mol M,平衡向逆反应方向移动 | |
| B. | 其他条件不变,向平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动 | |
| C. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| D. | 用X表示此反应的反应速率是(0.1-0.2a)mol•L-1min-1 |

 ,
, ,
, ;
; ,
, .
.