题目内容
5.过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如图1实验装置: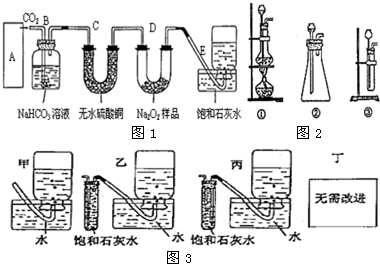
(1)A中制取CO2的装置,应从图2①、②、③中选哪个:②.
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?白色固体变蓝色.为了检验E中收集到的气体,在取出集气瓶后,用带火星的木条伸入集气瓶内,木条会出现复燃.
(2)若E中石灰水出现轻微浑浊,请说明原因:未反应的二氧化碳与石灰水反应所致.
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值小(大或小),相差约30毫升(取整数值,所用数据均在标准状况下测定),这可能是由于Na2O2可能含有其它杂质,D装置可能有氧气未被排出.
(4)你认为上述A---E的实验装置中,E部分是否安全、合理?不安全,不合理;E是否需要改进,若需要改进,应改为图3中的乙(填甲、乙、丙、丁).
分析 (1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,且反应需要较多二氧化碳,应用②装置制备;C装置中硫酸铜吸水转化为五水硫酸铜晶体;E中收集的气体为氧气,用带火星的木条检验;
(2)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)根据过氧化钠的质量可以计算理论上生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值;Na2O2可能含有其它杂质,D装置可能有氧气未被排出等会导致实际体积小于理论体积;
(4)与过氧化钠反应得到气体中会混有二氧化碳,用排饱和石灰水收集氧气,可以除去未反应的二氧化碳,但可能导致溶液倒吸现象,可以将E装置改为二氧化碳除杂装置、氧气收集装置.
解答 解:(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除①;③中只能制取少量二氧化碳而不能制取大量二氧化碳,所以排除③,且反应需要较多二氧化碳,故选②;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃.
故答案为:②;白色固体变蓝色;带火星;复燃
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致,
故答案为:未反应的二氧化碳与石灰水反应所致;
(3)1.95g过氧化钠完全反应生成氧气的体积为V,
2Na2O2----O2;
156g 22.4L
1.95g V
V=$\frac{1.95g×22.4L}{156g}$=0.28L=280mL>250mL,所以实际收集到的氧气体积比理论计算值小,相差280mL-250mL=30mL,可能原因是Na2O2可能含有其它杂质;D装置可能有氧气未被排出,
故答案为:小;30;Na2O2可能含有其它杂质,D装置可能有氧气未被排出;
(4)与过氧化钠反应得到气体中会混有二氧化碳,E中用排饱和石灰水收集氧气,可以除去未反应的二氧化碳,容易产生倒吸现象,所以不安全、不合理,所以需要改进,由于乙试管中进气管较长,二氧化碳能充分和饱和石灰水反应,丙试管中进气管较短,导致二氧化碳和饱和石灰水反应不充分,且随着气体的进入,试管中的液体被排到水槽中,故选乙,
故答案为:不安全,不合理;乙.
点评 本题考查气体制备实验,侧重考查学生的分析能力、实验能力,关键是对原理与装置的理解,难度中等.

| 化学键 | H-H | Cl-Cl | Cl-H |
| 键能/(kJ•mol-1) | 436 | 243 | 431 |
| A. | 862 kJ•mol-1 | B. | 679 kJ•mol-1 | C. | 183 kJ•mol-1 | D. | -183 kJ•mol-1 |

| A. | 香兰素的化学式为C8H8O3 | |
| B. | 能与Na2CO3和NaOH溶液反应 | |
| C. | 1 mol香兰素只能与含1 mol Br2的溴水反应 | |
| D. | 能使酸性高锰酸钾溶液褪色的官能团有羟基和醛基 |
| A. | 可供人类利用的淡水资源非常丰富 | |
| B. | 我国有多条大江大河和众多的湖泊,所以属于富水国家 | |
| C. | 每人每天约需2.5 kg水,加之人口急剧增加,地球上的淡水对满足人们的生活用水已很紧张 | |
| D. | 海水中含有大量的盐,人类无法从中提取淡水 |
| A. | SO42- OH- Cl- K+ | B. | Na+ NO3- OH- Cl- | ||
| C. | K+ Na+ NO3- Cl- | D. | K+ CO32+ H+ Ba2+ |
| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果,其作用是吸收并氧化水果释放出的乙烯 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化 |
| A. | 非金属单质燃烧时火焰均为无色 | |
| B. | NaCl与Na2CO3灼烧时火焰颜色相同 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | 所有金属及其化合物灼烧时火焰均有颜色 |