题目内容
【题目】将高温水蒸气通到硫氰化钠的表面,会发生反应:4NaSCN + 9H2O(g) = Na2CO3 + Na2S + 3CO2 + 3H2S + 4NH3。请完成下列填空:
(1)写出CO2的电子式____________,上述反应中具有10e-的物质是_____________。
(2)用电子式表示Na2S的形成过程:___________________________。
(3)上述反应中属于共价化合物的物质有_______________种。
(4)上述反应所涉及的各元素简单离子中,离子半径最大的是__________ (填离子符号);属于第二周期元素的非金属性由强到弱的顺序为_________________。
(5)Na2S、H2S、H2O三种物质的熔点由高到低的顺序是_____________________。
【答案】![]() H2O、NH3
H2O、NH3 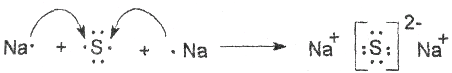 4 S2- O>N>C Na2S>H2O>H2S
4 S2- O>N>C Na2S>H2O>H2S
【解析】
(1)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;具有10e-的物质是H2O、NH3;
(2)硫原子最外层6个电子,反应中得到2个电子,钠原子最外层1个电子,在反应中失去最外层电子,生成离子化合物。据此用电子式表示Na2S的形成过程。
(3)非金属元素之间易形成共价键,上述反应中属于共价化合物的物质H2O、CO2 、H2S、NH3;
(4)上述反应所涉及的各元素简单离子有Na+和S2-,S2-比O2-多一个电子层,离子半径最大的是S2-;
周期元素的非金属性从左到右逐渐增强,属于第二周期元素的非金属性由强到弱的顺序为O>N>C;
(5)从晶体类型,氢键等角度分析。
(1)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,CO2的电子式![]() ;具有10e-的物质是H2O、NH3;
;具有10e-的物质是H2O、NH3;
(2)硫原子最外层6个电子,反应中得到2个电子,钠原子最外层1个电子,在反应中失去最外层电子,生成离子化合物。据此用电子式表示Na2S的形成过程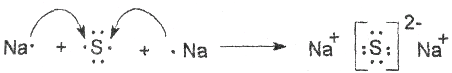 。
。
(3)非金属元素之间易形成共价键,上述反应中属于共价化合物的物质H2O、CO2 、H2S、NH3,共4种;
(4)上述反应所涉及的各元素简单离子有O2-、Na+和S2-,S2-比Na+、O2-多一个电子层,离子半径S2->O2->Na+,离子半径最大的是S2-;
周期元素的非金属性从左到右逐渐增强,所以第二周期元素的非金属性由强到弱的顺序为O>N>C;
(5)Na2S是离子晶体,熔点高于分子晶体,H2S、H2O是分子晶体,水分子之间形成氢键,水熔点高于硫化氢。Na2S、H2S、H2O三种物质的熔点由高到低的顺序是Na2S>H2O>H2S。