题目内容
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
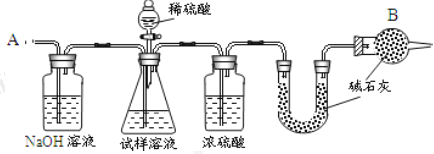
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明_________________。
(2)装置中干燥管 B 的作用是______________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是__________________________。
(5)步骤⑦的目的是__________________________。
(6)该试样中纯碱的质量分数的计算式为_______________________________。
【答案】 样品重,砝码轻 防止空气中的 CO2和水气进入 U 形管中 偏高 把反应产生的 CO2全部导入 U 形管中 判断反应产生的 CO2是否全部排出,并被 U 形管中的碱石灰吸收 ![]() ×100%
×100%
【解析】实验分析:本实验的目的为测定试样中Na2CO3的质量分数。实验原理为:w(Na2CO3)= 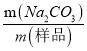 ×100%。先称取一定质量的样品,再将Na2CO3转化为CO2,利用碱石灰吸收CO2,通过称重得出CO2的质量,再间接的计算出Na2CO3的质量。为了精确测定CO2的质量,实验有两个关键点:保证CO2被全部吸收;防止其他气体的干扰。
×100%。先称取一定质量的样品,再将Na2CO3转化为CO2,利用碱石灰吸收CO2,通过称重得出CO2的质量,再间接的计算出Na2CO3的质量。为了精确测定CO2的质量,实验有两个关键点:保证CO2被全部吸收;防止其他气体的干扰。
(1)由于称量时左物右码,依据天平的杠杆原理,向左偏说明样品重,砝码轻。故答案为:样品重,砝码轻;
(2)U型管中的碱石灰是为了吸收反应生成的CO2,并通过称重得出CO2的质量,为了防止空气中的CO2和水蒸气进入影响实验结果,在U型管右侧接一个干燥管B,吸收空气中的CO2和水分。故答案为:防止空气中的CO2和水气进入U型管中;
(3)由于盐酸具有挥发性,也会随着CO2进入U型管,被碱石灰吸收,HCl被误认为是CO2,所以CO2的质量偏大,算出的Na2CO3的质量也会偏大的,所以结果会偏大。故答案为:偏高;
(4)由于反应完了锥形瓶中存留有CO2,鼓入一定量的空气就是将残留的CO2完全排入U型管。故答案为:把反应产生的CO2全部导入U型管中;
(5)直到U型管的质量基本不变,说明CO2已经被全部排到U型管中。故答案为:判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;
(6)设需要碳酸钠的质量为x,则:
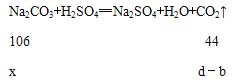
则有, ![]() ,解得x=
,解得x=![]() 。
。
所以试样中纯碱的质量分数的计算式为![]() ;故答案为:
;故答案为: ![]() ;
;