题目内容
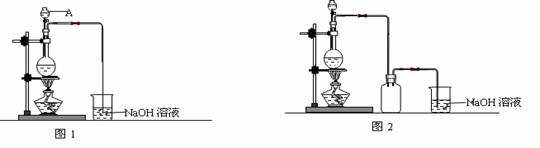
(1)下列装置1能组装成原电池的是

(2)对于锌-铜-稀硫酸组成的原电池装置,当导线中有0.1mol电子通过时,写出负极的电池反应式
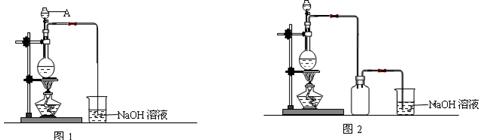
(3)如图2所示装置:若烧杯中溶液为氢氧化钠溶液,则负极为
(4)利用反应:Fe+2Fe3+=3Fe2+设计一个化学电池(电极材料和电解液自选),画出实验装置图3,注明电解质溶液名称和正负极材料.
I、Ⅲ
I、Ⅲ
.(填序号)
(2)对于锌-铜-稀硫酸组成的原电池装置,当导线中有0.1mol电子通过时,写出负极的电池反应式
Zn-2e-=Zn2+
Zn-2e-=Zn2+
,铜片上析出1.12L
1.12L
LH2(标准状况下).(3)如图2所示装置:若烧杯中溶液为氢氧化钠溶液,则负极为
Al
Al
,总反应方程为2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(4)利用反应:Fe+2Fe3+=3Fe2+设计一个化学电池(电极材料和电解液自选),画出实验装置图3,注明电解质溶液名称和正负极材料.
分析:(1)形成原电池时,必须形成闭合电路,且有电解质溶液,电极为活泼性不同的两种金属或金属与非金属;
(2)对于锌-铜-稀硫酸组成的原电池装置,锌为负极,发生氧化反应:Zn-2e-=Zn2+,正极发生还原反应:2H++2e-=H2↑,结合电极方程式计算生成氢气的体积;
(3)当溶液呈碱性时,铝能与NaOH溶液反应,而镁不反应,所以铝作负极,镁作正极,电池总反应和铝与NaOH溶液的反应相同,为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+.
(2)对于锌-铜-稀硫酸组成的原电池装置,锌为负极,发生氧化反应:Zn-2e-=Zn2+,正极发生还原反应:2H++2e-=H2↑,结合电极方程式计算生成氢气的体积;
(3)当溶液呈碱性时,铝能与NaOH溶液反应,而镁不反应,所以铝作负极,镁作正极,电池总反应和铝与NaOH溶液的反应相同,为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+.
解答:解:(1)Ⅱ中酒精不导电,不能形成原电池,Ⅳ没有形成闭合回路,不能形成原电池,Ⅰ、Ⅲ可以,故答案为:I、Ⅲ;
(2)对于锌-铜-稀硫酸组成的原电池装置,锌为负极,发生氧化反应:Zn-2e-=Zn2+,正极发生还原反应:2H++2e-=H2↑,
当导线中有0.1mol电子通过时,生成0.05molH2,
体积为0.05mol×22.4L/mol=1.12L,
故答案为:Zn-2e-=Zn2+;1.12L;
(3)当溶液呈碱性时,铝能与NaOH溶液反应,而镁不反应,所以铝作负极,镁作正极,电池总反应和铝与NaOH溶液的反应相同,为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al; 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+,乐为氯化铁或硫酸铁等,装置图为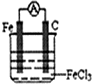 ,
,
故答案为: .
.
(2)对于锌-铜-稀硫酸组成的原电池装置,锌为负极,发生氧化反应:Zn-2e-=Zn2+,正极发生还原反应:2H++2e-=H2↑,
当导线中有0.1mol电子通过时,生成0.05molH2,
体积为0.05mol×22.4L/mol=1.12L,
故答案为:Zn-2e-=Zn2+;1.12L;
(3)当溶液呈碱性时,铝能与NaOH溶液反应,而镁不反应,所以铝作负极,镁作正极,电池总反应和铝与NaOH溶液的反应相同,为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al; 2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+,乐为氯化铁或硫酸铁等,装置图为
 ,
,故答案为:
 .
.点评:本题考查较为综合,涉及原电池的设计和工作原理的探究,为高考常见题型,侧重于基础知识的考查,题目难度不大,注意把握原电池的组成和原理,学习中注意基础知识的积累.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目