��Ŀ����
��6�֣�(1)��25�桢101kPa�£� 1g������ȫȼ������CO2��Һ̬H2O���ų�55 kJ��������д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
(2)2Zn��s��+O2��g��=2ZnO��s�� ��H1 = ��702 kJ/mol
2Hg��l��+O2��g��=2HgO��s�� ��H2 = ��182 kJ/mol
�ɴ˿�֪ZnO��s��+Hg��l��= Zn��s��+HgO��s�� ��H3= ��
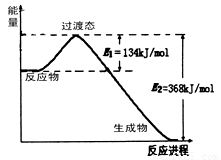
(3)20����30�����Eyring��Pelzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ������������̬����ͼ��NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ�� ��
���𰸡�
��1��CH4��g��+2O2��g��===== CO2��g��+ NO��g�� ��H = ��880 kJ/mol
��2����H3 =+260 kJ/mol
��3��NO2��g��+CO��g��===== CO2��g��+NO��g�� ��H = ��234 kJ/mol
��������

��ϰ��ϵ�д�
�����Ŀ