题目内容
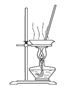
研究性学习小组对某硫酸亚铁晶体(FeSO4?xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
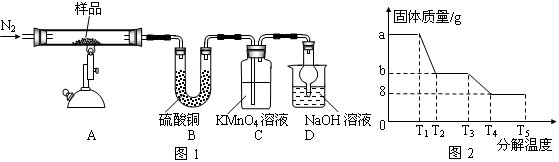
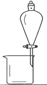
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
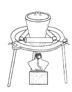
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x= 。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x= 。
(1)SO2, (2)偏小
(4)2FeSO4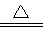 Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x= 7
Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x= 7
(4)2FeSO4
 Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x= 7
Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x= 7试题分析:解:(1)二氧化硫能使高锰酸钾溶液褪色,故答案为:二氧化硫。
(2)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,故答案为:偏小。
(3)硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,结合A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液的信息,因此A中红棕色固体是氧化铁;故为氧化铁。
(4)FeSO4的分解产物是Fe2O3、SO2、SO3,配平即可,故答案为:2FeSO4
 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。(5)装置D球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸,故答案为:干燥气体的作用并防止氢氧化钠溶液倒吸。
(6)通过FeSO4·xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
故答案为:7。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

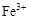 、
、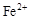 、
、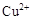 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表: 晶体质量(g)
晶体质量(g)
 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2