题目内容
【题目】氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
Ⅰ催化还原法
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
则CH4将NO2还原为N2的热化学方程式为____________________________。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
(3)在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。主要反应如下:2NO(g)+ 2CO(g)![]() N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
①前10分钟内用氮气表示的反应速率为___________,计算该温度下反应的平衡常数K为______Lmol-1。(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO 1.6 mol、CO2 0.4 mol,则此时反应的ν正___ν逆(填“<”、“=”或“> ”)
II 氧化法。
(4)首先利用ClO2 氧化氮氧化物,再利用还原剂还原为无毒的氮气。其转化流程如下:
NO![]() NO2
NO2![]() N2。
N2。
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是_____________________________;若生成11.2 L N2(标准状况),则消耗ClO2____________g 。
【答案】 CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol 增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(合理答案也计分) 0.02molL-1min-1 ![]() = 2NO2+ 4 Na2SO3==N2+ 4 Na2SO4 67.5
= 2NO2+ 4 Na2SO3==N2+ 4 Na2SO4 67.5
【解析】(1)考查热化学反应方程式的计算,CH4与NO2反应的方程式为CH4+2NO2=N2+CO2+2H2O,①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g), ②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g),盖斯定律,因此有(①+②)/2,得出:CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;(2)本题考查勒夏特列原理,提高氮氧化物的转化率,要求平衡向正反应方向移动,因此根据勒夏特列原理,采取措施是:增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等;(3)本题考查化学反应速率、化学平衡常数等知识,①根据化学反应速率的数学表达式,v(CO)=(1/1-0.6)/10mol/(L·min)=0.04 mol/(L·min),利用化学反应速率之比等于化学计量数之比,因此v(N2)=v(CO)/2=0.02 mol/(L·min);
2NO(g)+ 2CO(g)![]() N2(g)+ 2CO2(g)
N2(g)+ 2CO2(g)
起始浓度: 2 1 0 0
变化浓度: 0.4 0.4 0.2 0.4
平衡浓度: 1.6 0.6 0.2 0.4 根据平衡常数的表达式,K=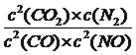 =
=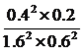 ;②根据Qc与K的关系,此时Qc=
;②根据Qc与K的关系,此时Qc=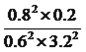 =K,即平衡不移动,v(正)=v(逆);(4)本题考查氧化还原反应方程式书写以及化学计算,根据转化流程图,NO2→N2,化合价由+4价→0价,化合价降低4价,Na2SO3中S的化合价由+4价→+6价,化合价升高2价,最小公倍数是4,因此反应方程式为2NO2 + 4Na2SO3=N2 + 4 Na2SO4,建立关系式为2ClO2~2NO2~N2,因此ClO2的质量为2×67.5×0.5g=67.5g。
=K,即平衡不移动,v(正)=v(逆);(4)本题考查氧化还原反应方程式书写以及化学计算,根据转化流程图,NO2→N2,化合价由+4价→0价,化合价降低4价,Na2SO3中S的化合价由+4价→+6价,化合价升高2价,最小公倍数是4,因此反应方程式为2NO2 + 4Na2SO3=N2 + 4 Na2SO4,建立关系式为2ClO2~2NO2~N2,因此ClO2的质量为2×67.5×0.5g=67.5g。

【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 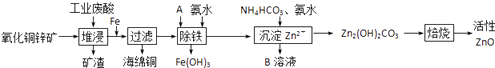
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .
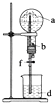
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 4molL﹣1NaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 热的浓的NaOH溶液 |
A.A
B.B
C.C
D.D