题目内容
使反应4NH3(g)+3O2(g)===2N2(g)+6H2O在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.6 mol。此反应的平均速率v(X)为( )
A.v(NH3)=0.02 mol·L-1·s-1 B.v(O2)=0.01 mol·L-1·s-1
C.v(N2)=0.02 mol·L-1·s-1 D .v(H2O)=0.02 mol·L-1·s-1
【答案】
A
【解析】
试题分析:半分钟后N2的物质的量增加了0.6 mol,v(N2)=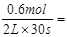 0.01mol·L-1·s-1。根据速率之比等于计量系数之比,可求得v(NH3)=0.02 mol·L-1·s-1,v(O2)=0.015 mol·L-1·s-1,v(H2O)=0.03 mol·L-1·s-1。答案选A。
0.01mol·L-1·s-1。根据速率之比等于计量系数之比,可求得v(NH3)=0.02 mol·L-1·s-1,v(O2)=0.015 mol·L-1·s-1,v(H2O)=0.03 mol·L-1·s-1。答案选A。
考点:化学反应速率的计算
点评:本题属于最基本的化学反应速率计算习题,较容易。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
|
使反应4NH3(g)+3O2(g) | |
| [ ] | |
A. |
v(NH3)=0.02 mol·L-1·s-1 |
B. |
v(O2)=0.01 mol·L-1·s-1 |
C. |
v(N2)=0.02 mol ·L-1·s-1 |
D. |
v(H2O)=0.02 mol ·L-1·s-1 |
使反应4NH3(g)+3O2(g)===2N2(g)+6H2O在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.6 mol。此反应的平均速率v(X)为( )
| A.v(NH3)=0.02 mol·L-1·s-1 | B.v(O2)=0.01 mol·L-1·s-1 |
| C.v(N2)=0.02 mol·L-1·s-1 | D.v(H2O)=0.02 mol·L-1·s-1 |