题目内容
(1)ag铁粉放入含bmolHNO3的浓硝酸中,加热充分反应后,再加入稀硫酸,铁粉恰好完全溶解,经测定溶液中只含Fe3+(一种金属离子)和SO42-(一种酸根离子).①写出反应开始时溶液中发生反应的化学方程式______ Fe(NO3)2+2NO2↑+2H2O
【答案】分析:(1)开始是浓硝酸和铁加热发生的反应,加入硫酸后,硝酸根离子在酸溶液中形成稀硝酸,可以氧化金属铁和亚铁离子,依据离子方程式产物和电荷守恒,原子守恒写出离子方程式;
(2)①依据接触法制硫酸的工业流程和设备反应分析判断;二氧化硫生成三氧化硫的反应是可逆反应,氧气是通入的空气,氮气不反应;
②依据三氧化硫吸收的方法是利用浓硫酸吸收,防止形成酸雾,阻止吸收分析判断;
③依据接触法制硫酸的反应原理结合化学方程式进行计算;
解答:解:①反应开始时溶液中发生反应,铁在加热条件下和浓硝酸发生的反应,再加入稀硫酸,铁粉恰好完全溶解,说明铁过量,反应的化学方程式为:Fe+4HNO3(浓) Fe(NO3)2+2NO2↑+2H2O;
Fe(NO3)2+2NO2↑+2H2O;
故答案为:Fe+4HNO3(浓)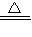 Fe(NO3)2+2NO2↑+2H2O;
Fe(NO3)2+2NO2↑+2H2O;
②铁和浓硝酸反应生成二价铁离子,再加入稀硫酸,铁粉恰好完全溶解,经测定溶液中只含Fe3+(一种金属离子)和SO42-(一种酸根离子);发生的反应是铁和稀硝酸反应,亚铁离子被硝酸氧化为三价铁离子,反应的两种方程式为:Fe+4H++NO3-═Fe3++NO↑+2 H2O; 3Fe2++4H++NO3-═3Fe3++NO↑+2 H2O;
故答案为:Fe+4H++NO3-═Fe3++NO↑+2 H2O; 3Fe2++4H++NO3-═3Fe3++NO↑+2 H2O;
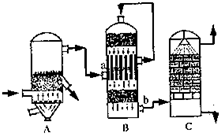
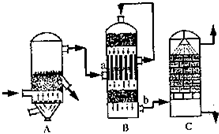
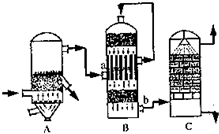
(2)①B设备是二氧化硫催化氧化为三氧化硫的设备在接触室进行反应,二氧化硫催化油器生成三氧化硫的反应是可逆反应,化学平衡状态下存在的物质有,SO3、SO2、O2、N2;
故答案为:接触室;SO3、SO2、O2、N2
②设备C中用98.3%的H2SO4来吸收SO2的原因是,用水吸收易形成酸雾阻止三氧化硫的吸收;
故答案为:为了提高SO3的吸收效率,防止形成酸雾;
③燃烧1t含硫质量分数为48%的黄铁矿石,在理论上能生产98%H2SO4
制硫酸的反应为:4FeS2+11O2=2Fe2O3+4SO2;2SO2+O2=2SO3;SO3+H2O=SO3;
依据硫元素守恒得到:设生成98%H2SO4xt
S~~~~H2SO4
32 98
1t×48% 98%×xt
得到x=1.5t
故答案为:1.5;
点评:本题考查了铁及其化合物性质的分析应用,硝酸的强氧化性,产物的判断,接触法制硫酸的工业流程,设备作用,题目难度中等.
(2)①依据接触法制硫酸的工业流程和设备反应分析判断;二氧化硫生成三氧化硫的反应是可逆反应,氧气是通入的空气,氮气不反应;
②依据三氧化硫吸收的方法是利用浓硫酸吸收,防止形成酸雾,阻止吸收分析判断;
③依据接触法制硫酸的反应原理结合化学方程式进行计算;
解答:解:①反应开始时溶液中发生反应,铁在加热条件下和浓硝酸发生的反应,再加入稀硫酸,铁粉恰好完全溶解,说明铁过量,反应的化学方程式为:Fe+4HNO3(浓)
 Fe(NO3)2+2NO2↑+2H2O;
Fe(NO3)2+2NO2↑+2H2O;故答案为:Fe+4HNO3(浓)
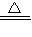 Fe(NO3)2+2NO2↑+2H2O;
Fe(NO3)2+2NO2↑+2H2O;②铁和浓硝酸反应生成二价铁离子,再加入稀硫酸,铁粉恰好完全溶解,经测定溶液中只含Fe3+(一种金属离子)和SO42-(一种酸根离子);发生的反应是铁和稀硝酸反应,亚铁离子被硝酸氧化为三价铁离子,反应的两种方程式为:Fe+4H++NO3-═Fe3++NO↑+2 H2O; 3Fe2++4H++NO3-═3Fe3++NO↑+2 H2O;
故答案为:Fe+4H++NO3-═Fe3++NO↑+2 H2O; 3Fe2++4H++NO3-═3Fe3++NO↑+2 H2O;
(2)①B设备是二氧化硫催化氧化为三氧化硫的设备在接触室进行反应,二氧化硫催化油器生成三氧化硫的反应是可逆反应,化学平衡状态下存在的物质有,SO3、SO2、O2、N2;
故答案为:接触室;SO3、SO2、O2、N2
②设备C中用98.3%的H2SO4来吸收SO2的原因是,用水吸收易形成酸雾阻止三氧化硫的吸收;
故答案为:为了提高SO3的吸收效率,防止形成酸雾;
③燃烧1t含硫质量分数为48%的黄铁矿石,在理论上能生产98%H2SO4
制硫酸的反应为:4FeS2+11O2=2Fe2O3+4SO2;2SO2+O2=2SO3;SO3+H2O=SO3;
依据硫元素守恒得到:设生成98%H2SO4xt
S~~~~H2SO4
32 98
1t×48% 98%×xt
得到x=1.5t
故答案为:1.5;
点评:本题考查了铁及其化合物性质的分析应用,硝酸的强氧化性,产物的判断,接触法制硫酸的工业流程,设备作用,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目