题目内容
【题目】我国科学家发明了一种“可固氮”的锂氮二次电池,将可传递离子的醚类做电解质,电池的总反应(固氮过程)为6Li+N2=2Li3N。下列说法不正确的是( )
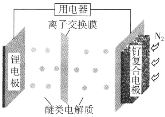
A.固氮时,阳极区发生反应Li-e-=Li+
B.脱氮过程,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C.醚类电解质可换成硫酸锂溶液
D.脱氮时,锂离子移向锂电极
【答案】C
【解析】
电池的总反应(固氮过程)为6Li+N2=2Li3N可知:固氮时锂失电子作负极,负极上电极反应式为6Li-6e-═6Li+,Li+移向正极,氮气在正极得电子发生还原反应,电极反应式为6Li++N2+6e-═2Li3N,脱氮是固氮的逆过程,据此解答。
A.根据分析,固氮时,锂失电子作负极,阳极区发生反应Li-e-=Li+,故A正确;
B.脱氮是固氮的逆过程,钌复合电极的电极失电子发生还原反应,电极反应为:2Li3N-6e-=6Li++N2↑,故B正确;
C.硫酸锂溶液中含有水,锂电极会与水发生剧烈反应,则不能换成硫酸锂溶液,故C错误;
D.脱氮时为电解池,阳离子向阴极移动,Li+向阴极锂电极迁移,故D错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:
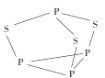
①P4S3分子中硫原子的杂化轨道类型为___。
②1molP4S3分子中含有的孤电子对的数目为___对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为___。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___。

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
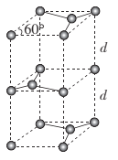
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___cm。